Влияние температуры. Энергия активации
Влияние температуры на скорость реакции отражено в правиле Вант-Гоффа. С увеличением температуры на каждые 10 К скорость химической реакции возрастает в 2-4 раза:
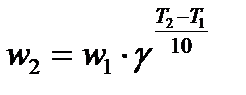
где γ – температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции при увеличении температуры на каждые 10 К; w1, w2 – скорости реакции при температуре T1 и T2 соответственно.
Для обычных химических реакций γ = 2 – 4.
Влияние температуры на скорость химической реакции связано с изменением константы скорости реакции, поэтому приведенное выше уравнение лучше представить так:
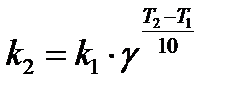
Сильное влияние температуры на скорость химической реакции объясняет теория активных столкновений. Основные постулаты этой теории:
‑ не каждое столкновение приводит к акту химического взаимодействия;
‑ к химическому взаимодействию приводит только те столкновения, в которых участвуют частицы, обладающие энергией, необходимой для данного взаимодействия (энергией активации);
‑ при соударении частицы должны быть определенным образом сориентированы относительно друг друга.
Энергия активации – это минимальная энергия взаимодействующих частиц, достаточная для того, чтобы все частицы вступили в химическую реакцию (Ea, кДж/моль).
Энергия активации реакции характеризует энергетический барьер, преодоление которого реагирующими частицами приводит к образованию конечных веществ. Энергия активации необходима для возникновения непрочного переходного комплекса [А···В], который не является химическим соединением в подлинном смысле этого слова, так как в нем происходит перераспределение химических связей между взаимодействующими атомами. Такой промежуточный комплекс неустойчив вследствие его высокой энергии и может быстро распадаться, образуя продукты реакции D и F.
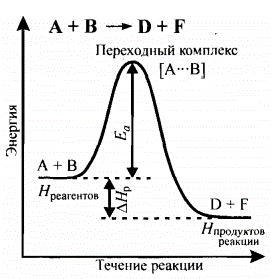
Энергетический профиль течения реакции
Энергия активации зависит от природы реагирующих веществ и пути протекания реакции и не зависит от температуры, если с ее изменением не произошло изменения механизма реакции. Опытным путем установлено, что реакции с Ea < 50 кДж/моль при 298 К идут с высокой скоростью. Это характерно для реакций с участием радикалов или ионов. Если реакция имеет Ea > 100 кДж/моль, то ее скорость при 298 К неизмеримо мала.
Источники активации реагирующих веществ могут быть различными:
‑ термическая активация в результате подвода теплоты из окружающей среды;
‑ действие различного рода излучений (свет, проникающая радиация);
‑ действие быстрых частиц, возникающих при ядерном распаде или в электрическом разряде.
При подводе энергии к системе происходит перераспределение этой энергии между частицами и увеличивается доля активных частиц, имеющих необходимую энергию для данного взаимодействия.
Энергия активации является очень важной энергетической характеристикой реакции, которая связана с константой скорости реакции уравнением Аррениуса:
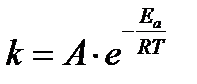
где k – константа скорости реакции при температуре T; А – предэкспоненциальный коэффициент (коэффициент Аррениуса), учитывающий частоту столкновения частиц, ориентированных определенным образом; е – основание натурального логарифма; Ea – энергия активации реакции, Дж/моль; R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
Из этого уравнения следует, что чем больше энергия активации, тем меньше будут константа и скорость химической реакции, так как в системе будет меньше число активных частиц. Если доля активных молекул превышает 10-7, то реакция идет практически мгновенно, а если эта доля меньше 10-18 – реакция при данных условиях практически не идет. При повышении температуры реакции за счет увеличения энергии системы резко возрастает число активных частиц, и этим объясняется значительное повышение скорости реакции.
Значение энергии активации реакции можно определить, измерив константы скорости этой реакции при двух разных температурах и используя следующее уравнение:
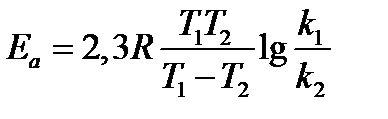
где k1 и k2 – константы скорости реакции при температуре T1 и T2.
Зная энергию активации, можно вычислить γ – температурный коэффициент скорости реакции:
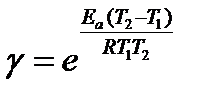
Высокая энергия активации делает практически невозможными многие реакции, которые, с точки зрения термодинамики, могли бы происходить. Очень многие из окружающих нас веществ находятся в термодинамически неустойчивом состоянии, и только наличие барьера активации препятствует их превращению в другие вещества. Исчезни энергия активации, тогда азот, кислород воздуха и вода океанов образовали бы азотную кислоту, все живые ткани разрушились бы вследствие реакции гидролиза и т.д. Эта химическая хаотизация невероятна из-за существования энергии активации – характернейшей черты любых химических превращений. Молекула любого вещества потому и существует, что изменения ее состояния связаны с преодолением энергетического барьера, т.е. с энергией активации на пути ее превращения.
Дата добавления: 2021-02-19; просмотров: 770;











