Кинетические уравнения и порядок реакции
В зависимости от вида кинетического уравнения, связывающего скорость реакции с концентрацией реагирующих веществ, различают реакции нулевого, первого, второго и третьего порядка.
Рассмотрим кинетические уравнения односторонних реакций, порядок которых дается целым числом.
Для характеристики скорости реакции наряду с константой скорости часто используют время полупревращения (τ1/2) или период полупревращения.
Период полупревращения – это промежуток времени, в течение которого прореагирует половина начального количества вещества (С = С0 /2) (Со – исходная (начальная) концентрация; C – текущая концентрации).
Реакции нулевого порядка.Такой порядок реакции означает, что еѐ скорость не зависит от концентрации реагирующих веществ. Это возможно при поддержании концентрации исходных веществ постоянными. Например, реакция протекает в насыщенном растворе, находящемся в контакте с избытком нерастворенного реагирующего вещества. Этот порядок встречается главным образом среди гетерогенных реакций.
Если реакция протекает по нулевому порядку, то для нее
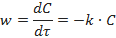
Для них константа скорости определяется выражением:
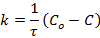
и имеет размерность [С / время].
За время полупревращения τ = τ1/2 исходная концентрация реагирующего вещества уменьшается наполовину С = С0 /2.
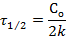
Следовательно, для реакции нулевого порядка время полупревращения пропорционально начальной концентрации исходного вещества.
Реакции первого порядка– это реакции изомеризации, термического разложения веществ, радиоактивного распада атомных ядер, многие бимолекулярные реакции, если концентрация одного из реагирующих веществ постоянна. Схематично такие реакции можно записать:
A → продукты
Скорость таких реакций w прямо пропорциональна концентрации реагирующего вещества C в данный момент времени τ:
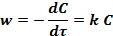
Решение уравнения дает выражение для константы скорости реакции:
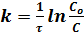 или
или 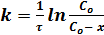
где С0 - начальная концентрация реагирующего вещества; c - концентрация ко времени τ; Со – x – убыль вещества ко времени τ.
Размерность константы скорости k = [τ –1].
Время реакции может измеряться как в часах, так и в долях секунды, в веках и др.
Время полупревращения для реакций первого порядка рассчитывается по уравнению:
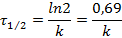
Для реакций первого порядка период полупревращения не зависит от начальной концентрации исходного вещества, константа скорости обратно пропорциональна периоду полупревращения.
Реакции второго порядкавстречаются наиболее часто. К ним относятся реакции термического образования и разложения, процессы димеризации, омыление сложных эфиров, этерификация и др. В общем виде реакцию второго порядка можно представить схемой:
А + В → продукты.
При равных начальных концентрациях реагирующих веществ (СоА = СоВ = Со) или в случае, когда оба реагирующих вещества одинаковы, скорость реакции выражается следующим образом:
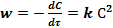 или
или 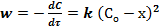
Константа скорости реакции второго порядка равна:
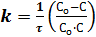 или
или 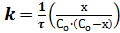
При СоА ≠ СоВ уравнение скорости реакции второго порядка
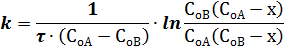
где СоА и СоВ - начальные концентрации веществ А и В; х - уменьшение концентрации веществ А или В к моменту времени t , то есть Сx .
Размерность k второго порядка [С-1 τ-1] Время полупревращения 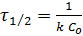
Реакции третьего порядкаочень редки. В простейшем случае для реакции
A + B + D → продукты
при равенстве начальных концентраций СоА = СоВ = СоD= Со
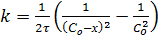 ,
,
Размерность константы скорости реакции третьего порядка - [С2 τ –1].
Период полупревращения реакций третьего порядка, определяется выражением:
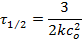
Дробный порядок указывает на одновременное протекание реакции в несколько этапов, которые мало отличаются друг от друга по скоростям, или на протекание обратимых реакций.
Дата добавления: 2021-02-19; просмотров: 439;











