Кинетическая классификация реакций.
В зависимости от того, что взято за основу классификации, химические реакции можно разделить по следующим признакам:
1. По агрегатному состоянию среды:
- в газовой фазе;
- в растворах;
- в твердых средах.
2. По фазовому состоянию исходных и образующихся веществ:
- гомогенные реакции, протекающие в пределах одной фазы: в смеси газов, в жидком растворе или в твердой фазе;
- гетерогенные реакции, протекающие на границе раздела фаз: двух твердых, твердой и жидкой, твердой и газообразной, двух жидких, жидкой и газообразной.
- гомогенно-гетерогенные реакции, являющиеся сложными химическими реакциями, в которых одни стадии являются гомогенными, а другие - гетерогенными;
- гомофазные реакции, в которых исходные вещества, промежуточные вещества и продукты реакции находятся в одной фазе;
- гетерофазные реакции, в которых исходные вещества, промежуточные вещества и продукты реакции образуют более чем одну фазу.
3. По природе частиц, участвующих в элементарном акте:
- молекулярные, в которых участвуют молекулы;
- цепные, с участием атомов или свободных радикалов;
- ионные, с участием ионов;
- фотохимические;
- радиохимические;
- электрохимические.
4. По степени сложности:
- простые, протекающие в одну стадию;
- сложные, протекающие в несколько стадий и по разным направлениям.
5. По кинетической обратимости:
- необратимые или односторонние. Общая скорость этих реакций определяется только скоростью прямой реакции;
- обратимые или двусторонние. В них скорость прямой и обратной реакции соизмеримы.
Скоростью химической реакции называется изменение концентрации одного из реагирующих веществ за единицу времени.
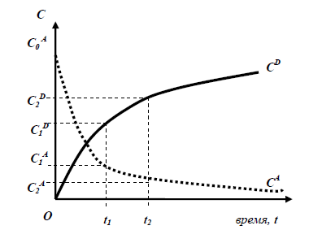
|
| Рис. 1 Изменение концентрации реа- гирующих веществ и продуктов во времени |
Предположим, что имеется реакция, описываемая следующимуравнением:
aA + bB = dD + eE,
где А и В – исходные вещества;
D и E – продукты реакции;
a, b, d и e –стехиометрические коэффициенты.
О скорости этой реакции можно судить по скорости уменьшения концентрации исходного вещества А или В; а также по скорости увеличения (накопления) концентрации продуктов D или E.
Графически изменение концентрации веществ А и D во времени отображаются зависимостями, представленными на рис. 1 (кривые CA и CD соответственно).
Различают среднюю и истинную скорости:
Средней скоростьюwср химической реакции называют изменение концентрации ΔС реагирующего вещества, отнесенное к конечному интервалу времени Δt, в течение которого это изменение произошло.
Для рассматриваемой реакции выражение для средней скорости реакции за интервал времени Δτ по веществу А:
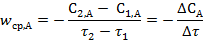
или по компоненту D:
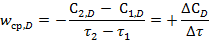
Скорость реакции принято считать положительной величиной. Отношение же ΔC/Δτ может быть как положительным, так и отрицательным, в зависимости от соотношения концентраций в начальном и конечном моментах времени. В выражение скорости по исходному веществу ставят знак минус, а по продукту реакции – плюс.
В общем случае перед выражением скорости химической реакции принято ставить знаки «±»:
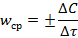
Истинной скоростьюреакции w в данный момент времени называется изменение концентрации какого-либо компонента, отнесенное к бесконечно малому промежутку времени:
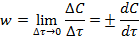
Единица измерения скорости [моль/(л·с)].
Скорость реакции зависит от ряда факторов: природы реагирующих веществ, концентрации, температуры и присутствия катализаторов.
Дата добавления: 2021-02-19; просмотров: 485;











