Энергия активации - это разность между наименьшим избыточным значением энергии частиц необходимым для осуществления реакции и средним значением энергии исходных веществ.
Разность Е1-Е2 равна тепловому эффекту реакции ΔН.
Не любое соударение частиц приводит к химической реакции с ними. Для того, чтобы столкновение было результативным частицы должны обладать некоторым значением энергии. Чем больше энергия активации, тем меньше скорость химической реакции.
Энергия активации является постоянной величиной для данной химической реакции и не зависит от температуры, а скорость реакции зависит. Чем меньше температура, тем выше средняя энергия исходных веществ, тем больше скорость реакции.
Константа скорости химической реакции связана с величиной энергии активации уравнением Аррениуса: 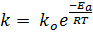
где ko – предэкспоненциальный множитель, зависящий от природы реагирующих веществ.
Для расчета энергии активации Еa применяют расчетный и графический методы.
Расчетный способ: энергию активации химической реакции можно вычислить по значениям констант скоростей при двух различных температурах по уравнению:
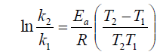
Уравнение для расчета энергии активации имеет вид:
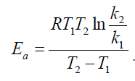
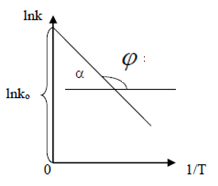
Графический: поэкспериментальным данным необходимо построить график в координатах lnk - 1/T. На графике (рис.) получается прямая линия, тангенс угла наклона которой равен: tgα = Еа / R . Тангенс угла наклона рассчитывают по отношению катетов треугольника.
| 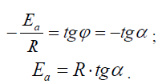
|
Дата добавления: 2021-02-19; просмотров: 553;











