Зависимость скорости от концентрации реагирующих веществ
Зависимость скорости реакции от концентрации реагирующих веществ определяет основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции при условиях постоянства всех остальных факторов (температуры, состава).
Например, если реагируют вещества А и В, то
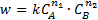
где k - константа скорости реакции; ni –порядок реакции по данному i-му реагенту.
Это аналитическое выражение закона, установленного в 1867 году норвежскими учеными К. М. Гульдбергом и П. Вааге. Он известен под названием закона действующих масс.
Коэффициент пропорциональности k называется константой скорости химической реакции. Константа скорости реакции kчисленно равна скорости реакции, если концентрации всех участников реакции равны единице. По физическому смыслу константа скорости – это удельная скорость реакции или стандартная скорость (при ci=1), поэтому еѐ величина зависит от всех факторов, которые влияют на скорость реакции, за исключением концентрации реагирующих веществ. Единицы ее измерения определяются видом кинетического уравнения.
Порядок реакции
Порядок реакции определяется величиной показателя степени в кинетическом уравнении реакции. Каждый из показателей степени при концентрациях (n1 и n2) выражает частный порядок реакции по данному компоненту. Сумма показателей степени при концентрациях (n1+n2) определяет полный порядок реакции.
n = n1 + n2.
Он может принимать целые, дробные, положительные, отрицательные, а также нулевые значения. Если стехиометрическое уравнение правильно отражает истинный механизм реакции, то n1=a и n2=b.
Только для простых реакций уравнение скорости соответствует стехиометрическому уравнению.
Порядок реакции понятие формальное, поскольку в большинстве случаев не отражает механизма реакции. Определяется порядок реакции экспериментально и отражает зависимость скорости реакции от концентрации вещества.
Если скорость реакции не зависит от концентрации реагирующих веществ, то реакция имеет нулевой порядок.
Если скорость реакции зависит от концентрации вещества в первой степени, то это реакция первого порядка; если во второй степени, то это реакция второго порядка и так далее.
Дата добавления: 2021-02-19; просмотров: 413;











