Теории химической кинетики
1) Теория активных столкновений была разработана Аррениусом на базе молекулярно-кинетических представлений. Согласно этой теории, для того чтобы между веществами А и В произошла реакция, их молекулы должны столкнуться. Частота столкновений Z пропорциональна произведению концентраций [А]·[В]. Если бы каждое столкновение приводило к химическому взаимодействию, скорость равнялась бы частоте столкновений. Расчеты показывают, что скорости химических реакций были бы очень высоки.В действительности частота столкновений Z на много порядков больше реальных скоростей химических реакций.
Аррениус предположил, что только активные столкновения молекул приводят к химическому взаимодействию. Под активными столкновениями понимают столкновения, в которых суммарная энергия поступательного движения по линии, соединяющей центры сталкивающихся молекул, больше либо равна некоторой минимальной энергии.
Минимальная энергия, которая необходима для того, чтобы между молекулами при их столкновении произошло химическое взаимодействие, получило название энергии активации.
Соотношение между константой скорости реакции, частотой столкновений и долей активных столкновений описывает уравнение Аррениуса:
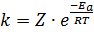
где k – константа скорости реакции; Z – частота столкновений (число столкновений в единице объема за единицу времени); Еа – энергия активации, Дж/моль; R - универсальная газовая постоянная; Т – абсолютная температура, К.
Множитель 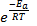 называют экспоненциальным, он характеризует долю активных столкновений молекул от общего числа.
называют экспоненциальным, он характеризует долю активных столкновений молекул от общего числа.
Из уравнения Аррениуса видно, что доля активных столкновений, а значит и константа скорости тем больше, чем меньше энергия активации и чем выше температура.
2) Теория активированного комплекса. Эту теорию предложили Г. Эйринг и М. Поляни (1935). Основные положения:
- при сближении реагирующих частиц наблюдается почти непрерывный переход из начального состояния в конечное, который протекает через образование переходного комплекса с максимальной потенциальной энергией;
- переходный комплекс находится в равновесии с исходными веществами;
-образованиe переходного комплекса является лимитирующей стадией процесса;
-энергия активации представляет собой разность энергий активированного комплекса и средней энергии исходных веществ.
Например, рассмотрим механизм реакции А + ВС → АВ + С
Согласно теории активированного комплекса при сближении атома А с молекулой ВС ослабляется связь В – С и возникает связь А – В. Процесс завершается образованием молекулы АВ и атома С, для чего система должна пройти через активированный комплекс АВС*, когда атом В в одинаковой степени принадлежит молекулам ВС и АВ:
А + ВС → АВС* → АВ + С.
Сложные реакции
Многие реакции имеют дробный или изменяющийся во времени порядок, поскольку они протекают по определенному механизму, включающему более одной стадии. Сложные реакции – это несколько одновременно протекающих химических реакций с общими реагентами. Каждая из них идѐт независимо от других и подчиняется закону действующих масс.
К ним относятся параллельные, последовательные, обратимые, сопряженные и др. реакции.
Дата добавления: 2021-02-19; просмотров: 825;











