Реальные газы. Уравнение Ван-дер-Ваальса Фазовые равновесия и переходы
Состояние 1 киломоля реального газа описывается уравнением Ван – дер – Ваальса:
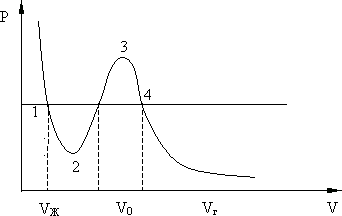
Рис. 8.6.
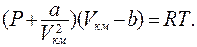 (8.24)
(8.24)
От уравнения состояния идеального газа это уравнение отличается поправками 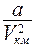 и
и 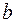 . Поправка
. Поправка 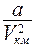 характеризует влияние на давление взаимодействия молекул, приводящего к эффекту большего сжатия:
характеризует влияние на давление взаимодействия молекул, приводящего к эффекту большего сжатия: 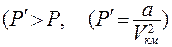 . Поправка b характеризует часть объема, недоступную для движения, т.к. молекулы занимают этот объем.
. Поправка b характеризует часть объема, недоступную для движения, т.к. молекулы занимают этот объем.
Для n киломолей уравнение Ван – дер – Ваальса:
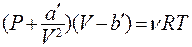 (8.25)
(8.25)
где 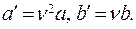
Уравнение Ван – дер – Ваальса описывает не только газообразное состояние при объеме 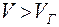 , но и жидкое состояние при объеме V < Vж .
, но и жидкое состояние при объеме V < Vж .
На рис. 8.6 приведена изотерма Ван – дер – Ваальса. При 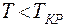 у изотерм Ван – дер – Ваальса имеется S – образный завиток, поэтому данному значению давления соответствует 3 значения объема:
у изотерм Ван – дер – Ваальса имеется S – образный завиток, поэтому данному значению давления соответствует 3 значения объема: 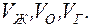 При
При 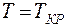 горизонтальный участок (1 - 4) стягивается в точку К, называемую критической точкой. На участках (1 – 2) и (3 – 4)
горизонтальный участок (1 - 4) стягивается в точку К, называемую критической точкой. На участках (1 – 2) и (3 – 4) 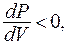 состояние неустойчиво, оно соответствует перегретой жидкости (1 – 2) и пересыщенному пару (3 – 4).
состояние неустойчиво, оно соответствует перегретой жидкости (1 – 2) и пересыщенному пару (3 – 4).
На участке (2 – 3) 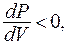 поэтому он не отвечает реальному состоянию.
поэтому он не отвечает реальному состоянию.
Фаза – совокупность однородных, одинаковых по свойствам частей системы (вода, лед, смесь воды и льда). На рис. 8.7 представлена фазовая диаграмма. Кривая равновесного сосуществования фаз: (1 – 2) – твердой и газовой, (2 – 3) - жидкой и газовой, (2 – 4) – твердой и жидкой, 2 – тройная точка, 3 – критическая точка.
Равновесие фаз возможно только в определенном интервале температур и давлений.
Три фазы одного вещества также могут находиться в равновесии, но только при температуре и давлении, соответствующих тройной точке 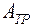 на диаграмме
на диаграмме  . Ветвь зависимости
. Ветвь зависимости 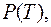 соответствующая равновесию жидкости и газа, заканчивается в критической точке
соответствующая равновесию жидкости и газа, заканчивается в критической точке 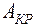 . При
. При 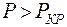 вещество находится в жидком или газообразном состоянии. При
вещество находится в жидком или газообразном состоянии. При 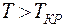 газ нельзя перевести в жидкость путем изотермического сжатия.
газ нельзя перевести в жидкость путем изотермического сжатия.
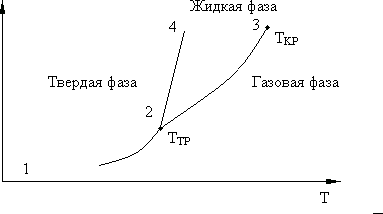
Рис. 8.7.
Фазовые кривые аналитически описываются уравнением Клапейрона – Клаузиуса:
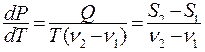 (8.26)
(8.26)
где Q – теплота фазового перехода, 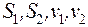 – энтропии и удельные объемы фаз.
– энтропии и удельные объемы фаз.
Фазовые переходы первого рода связаны с поглощением или выделением энергии, равной теплоте фазового перехода. Примеры фазовых переходов первого рода: испарение – переход из жидкой в газовую фазу, сублимация – переход твердой фазы в газовую и т.д.
Фазовые переходы второго рода происходят без поглощения или выделения теплоты. Примеры фазовых переходов второго рода: переход металлов и сплавов из нормального состояния в сверхпроводящее, переход жидкого гелия из фазы He-I в фазу He-II, переход из ферромагнитного в парамагнитное состояние и др.
Рассмотрим более подробно процесс фазового перехода первого рода между жидкостью и паром. На рис. 8.8 приведена изотерма, на оси абсцисс указаны объемы Vж .и 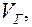 занимаемые веществом при переходе в жидкое и газообразное состояния.
занимаемые веществом при переходе в жидкое и газообразное состояния.
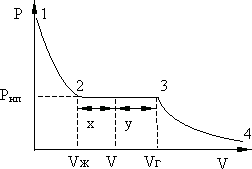
Рис. 8.8.
Если вначале вещество было в газовой фазе, то с уменьшением объема до 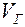 давление растет, затем на участке от
давление растет, затем на участке от 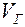 до Vж вещество становится двухфазным, при дальнейшем уменьшении объема вещества происходит переход в жидкую фазу. Равновесие между жидкостью и газом характеризуется давлением
до Vж вещество становится двухфазным, при дальнейшем уменьшении объема вещества происходит переход в жидкую фазу. Равновесие между жидкостью и газом характеризуется давлением 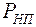 , называемым давлением насыщенного пара.
, называемым давлением насыщенного пара.
Условие равновесия жидкости и пара:
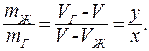 (8.27)
(8.27)
Дата добавления: 2019-09-30; просмотров: 756;











