АДСОРБЦИОННЫЕ РАВНОВЕСИЯ
Величина адсорбции зависит от природы поверхности адсорбента, природы адсорбата и его концентрации (давления), температуры и др. Графическая зависимость адсорбции от концентрации адсорбируемого вещества в объемной фазе при данной температуре называется изотермой адсорбции.
Адсорбция из предельно разбавленных растворов или смесей газов подчиняется закону Генри:
А = КГ . С или А = КГ¢ . Р (3.1)
где КГ и КГ¢ – константа Генри;
с – концентрация адсорбата в объемной фазе;
Р – давление пара адсорбата.
Аналитическим выражением изотермы мономолекулярной адсорбции при более высоких концентрациях и на ровной поверхности является уравнение Ленгмюра:
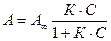 или
или 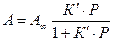 (3.2)
(3.2)
где А¥ – предельная мономолекулярная адсорбция – емкость монослоя;
КС и К¢ – константы адсорбционного равновесия, характеризующие энергию адсорбции.
Для высоких давлений пара изотерма адсорбции описывается общим уравнением обобщенной теории Ленгмюра – уравнением полимолекулярной адсорбции БЭТ (Браунауэра, Эммета и Теллера):
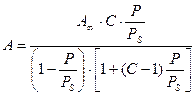 (3.3)
(3.3)
где С – константа, характеризующая энергию взаимодействия сконденсированного адсорбата с поверхностью адсорбента;
рs – давление насыщенного пара адсорбата.
Уравнение Ленгмюра (3.2) и уравнение БЭТ (3.3) широко используются для определения удельной поверхности адсорбентов, катализаторов и других дисперсных систем. Удельная поверхность Sуд связана с емкостью монослоя А¥ соотношением
Sуд = А¥ . NA. s0 , (3.4)
где NA – число Авогадро;
s0 – площадь, занимаемая одной молекулой адсорбата в насыщенном адсорбционном слое.
Для описания адсорбции на пористых телах с переходными порами (мезопористые адсорбенты) используют уравнение капиллярной конденсации Кельвина, которое позволяет определить размеры пор. Если тело в основном имеет микропоры, то применяют уравнение теории объемного заполнения микропор:
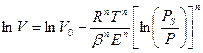 (3.5)
(3.5)
где V – объем заполненных пор при данном давлении;
V0 – общий объем пор в абсорбенте;
b – коэффициент аффинности, характеризующих природу адсорбата;
Е – характеристическая энергия адсорбции;
n – показатель степени, выражаемый целыми числами от 1 до 6.
Энергетические параметры адсорбции (изменение энтальпии, энтропии, энергии Гиббса) обычно рассчитывают из температурных зависимостей адсорбции. Например, из уравнений Клайперона-Клаузиуса или Вант-Гоффа можно получить следующую теоретическую изостеру (А = const):
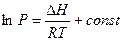 (3.6)
(3.6)
где DН – изменение энтальпии при адсорбции.
По экспериментально построенной зависимости в координатах уравнения (3.6) можно определить (по тангенсу угла наклона) дифференциальные мольные (изостерические) энтальпии адсорбции при данных степенях заполнения (при данных А).
Стандартная энергия Гиббса DGо адсорбции связана с равновесной константой адсорбции K соотношением
DGo = – RTlnK (3.7)
Зная стандартную энтальпию и энергию Гиббса, легко вычислить стандартную энтропию адсорбции.
Поверхностно-активные вещества отличаются высокой адсорбционной способностью, и для них А » Г. Это позволяет применительно к ПАВ совместно решить уравнения Гиббса
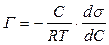 (3.8)
(3.8)
где Г – величина адсорбции компонентов раствора (при малых концентрациях С адсорбата в бинарном растворе);
s – поверхностное натяжение,
и Генри (3.1). Совместное решение дает линейную изотерму поверхностного натяжения при малых концентрациях ПАВ в растворе:
s = s0 – KГRTc (3.9)
где s0 – поверхностное натяжение растворителя.
Принимая разность s0 – s за поверхностное (двухмерное) давление p, получим уравнение состояния идеального двухмерного газа:
pSм = RT (3.10)
где Sм – поверхность, на которой распределен 1 моль ПАВ.
Совместное решение адсорбционного уравнения Гиббса (3.8) с уравнением Ленгмюра (3.2) для ПАВ дает уравнение Шишковского, связывающее изменение поверхностного натяжения раствора с концентрацией растворенного ПАВ в объеме:
s = s0 – A¥ . R . T . ln (l + Kc) (3.11)
В этом случае уравнение состояния двухмерного газа имеет вид
p (Sм – Sм,0) = R . T (3.12)
где Sм,0 = 1/A¥, т. е. поверхность, занимаемая 1 моль ПАВ в адсорбционно насыщенном мономолекулярном слое.
Уравнения Гиббса, Генри, Ленгмюра и Шишковского по экспериментальным данным о поверхностном натяжении растворов позволяют рассчитать следующие величины и характеристики: адсорбцию ПАВ на межфазной границе раствор – воздух и раствор – твердый адсорбент; толщину адсорбционного слоя; линейные размеры молекул ПАВ; предельную адсорбцию поверхностного мономолекулярного слоя; удельную поверхность твердого адсорбента, катализатора, а также исследовать свойства поверхностных пленок.
В настоящее время широко распространена ионообменная адсорбция с помощью ионитов, которые представляют собой твердую матрицу с ионогенными функциональными группами. Если матрица несет отрицательный заряд (фиксирован анион), а обмениваются катионы, адсорбент является катионитом. Если матрица заряжена положительно, а подвижные противоионы несут отрицательный заряд, адсорбент является анионитом. Иониты со смешанными группами называют амфолитами.
Основными характеристиками ионообменных адсорбентов являются их обменная емкость и константа ионного обмена, характеризующая избирательную способность ионита. Обменная емкость – количество ионов (в эквивалентах), поглощенных единицей массы сорбента или единицей объема набухшего ионита. При ионообменной адсорбции происходит стехиометрический обратимый обмен ионов M1 и М2 между объемом раствора электролитов и адсорбентом:
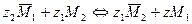 (3.13)
(3.13)
где 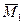 и
и 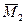 – ионы, адсорбированные на ионите.
– ионы, адсорбированные на ионите.
Равновесное состояние описывается уравнением константы ионного обмена:
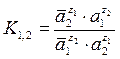 (3.14)
(3.14)
где ā и а – термодинамические активности обменивающихся ионов соответственно в ионите и растворе;
z1, z2 – заряды ионов 1 и 2.
Возводя левую и правую часть полученного выражения в степень, равную l/(z1.z2), получаем уравнение Никольского для обмена поливалентных ионов:
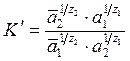 (3.15)
(3.15)
На практике обычно вместо активностей используют концентрации.
С помощью ионообменной адсорбции можно извлечь ионы или разделить их, изменить кислотность раствора или сделать его нейтральным и т.д.
Адсорбция лежит в основе метода разделения компонентов смесей, называемого хроматографией. Хроматографическоеразделение происходит при движении подвижной фазы (раствор, газовая смесь) относительно другой неподвижной фазы (обычно адсорбент или инертный носитель, пропитанный жидкостью) вследствие различного сродства разделяемых веществ с фазами.
В зависимости от агрегатного состояния контактирующих фаз различают четыре вида хроматографии: газо-адсорбционную, газожидкостную, жидкостно-адсорбционную, жидкостно-жидкостную. По оформлению процесса хроматографию делят на колоночную и плоскослойную (тонкослойную и на бумаге). Существует три метода проведения хроматографии: фронтальный, вытеснительный и элюентный (проявительный). При первом методе разделяемую смесь непрерывно подают через хроматографическую колонку. В вытеснительном и проявительном методах после подачи разделяемой смеси в колонну вводят соответственно или вытеснитель, который сорбируется лучше разделяемых веществ, или чистый растворитель, слабо реагирующий с адсорбентом.
Дата добавления: 2020-07-18; просмотров: 1036;











