Характеристики жидкого состояния
Жидкость – конденсированное состояние вещества, промежуточное между твердым и газообразным. Свойства жидкости зависят от химического строения частиц и взаимодействия между ними. Жидкости можно условно разделить на следующие группы:
1. Атомарные жидкости, состоящие из атомов или сферических молекул, связанных ван – дер – ваальсовыми силами (Аr, CH4). Они обладают наведенным дипольным электрическим моментом;
2. Двухатомные жидкости, содержащие одинаковые атомы (H2, N2). Обладают квадрупольным электрическим моментом;
3. Жидкие непереходные металлы (Na, Hg). Взаимодействие имеет кулоновский характер;
4. Полярные жидкости (HBr), взаимодействие имеет дипольный характер;
5. Жидкости с водородными связями (H2O);
6. Жидкости, состоящие из больших молекул, взаимодействие зависит от внутренних степеней свободы.
Жидкости первых двух групп называется простыми, т.к. они в настоящее время изучены лучше, чем остальные.
Свойства жидкостей:
1. Самодиффузия частиц жидкости связана с постоянными переходами из одного положения равновесия в другое.
2. Текучесть жидкости связана с направленностью движения частиц жидкости под действием приложенной силы.
3. Вязкость – свойство реальной жидкости, являющееся следствием взаимодействия частиц между собой.
4. Сжимаемость – зависимость объема, занимаемого жидкостью, от давления. Жидкости обладают малой сжимаемостью, близкой к сжимаемости твердого тела.
5. Анизотропия механическая, оптическая, т.е. зависимость х свойств вещества от направления.
6. Прохождение точки замерзания без изменения свойств, в отличие от плавления кристалла, характеризующегося определенной температурой.
Контрольные вопросы:
1. Основные положения молекулярно – кинетической теории.
2. Основные величины молекулярной физики: атомная масса, молекулярная масса.
3. Основные величины молекулярной физики: молярная масса, концентрация, плотность.
4. Уравнение состояния идеального газа.
5. Газовые законы. Диаграммы газовых законов.
6. Уравнение Менделеева – Клапейрона.
7. Основное уравнение молекулярно – кинетической теории.
8. Взаимодействие молекул. Реальные газы.
9. Уравнение Ван – дер – Ваальса.
10. Фазовые равновесия и переходы.
11. Характеристики жидкого состояния.
ГЛАВА 9. РАВНОВЕСНАЯ ТЕРМОДИНАМИКА
Внутренняя энергия
В основе термодинамики находятся законы, связывающие между собой различные формы энергии. В курсе механики мы изучали понятие механической энергии тела. Если тело движется со скоростью 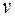 , то оно обладает кинетической энергией:
, то оно обладает кинетической энергией:
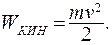 (9.1)
(9.1)
Если тело находится во внешнем поле, заданном в каждой точке некоторым потенциалом j, тогда можно определить его потенциальную энергию 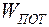 . Так, для тела в гравитационном поле потенциальная энергия и потенциал выражаются соотношениями:
. Так, для тела в гравитационном поле потенциальная энергия и потенциал выражаются соотношениями:
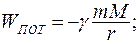
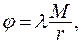 (9.2)
(9.2)
где m, M - массы взаимодействующих тел;
r - расстояние между их центрами;
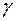 - гравитационная постоянная.
- гравитационная постоянная.
Полная механическая энергия складывается из кинетической энергии движения тела как целого и потенциальной энергии во внешнем поле сил:
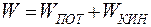 (9.3)
(9.3)
Обратите внимание, что закон сохранения полной механической энергии не выполняется, если на тело действуют силы, приводящие к диссипации энергии. Например, для совершения работы против сил трения затрачивается некоторое количество механической энергии. Если в процессе соударения тел произошла их деформация, то часть механической энергии теряется.
Куда же исчезает механическая энергия? Нужно вспомнить о том, что тело состоит из движущихся молекул, обладающих кинетической энергией 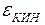 . Они взаимодействуют между собой: притягиваются и отталкиваются, образуют устойчивые связи, как в твёрдом теле, или временные, как в жидкости, молекулы которой обладают большой подвижностью, следовательно, можно говорить о потенциальной энергии взаимодействия
. Они взаимодействуют между собой: притягиваются и отталкиваются, образуют устойчивые связи, как в твёрдом теле, или временные, как в жидкости, молекулы которой обладают большой подвижностью, следовательно, можно говорить о потенциальной энергии взаимодействия 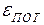 . Кроме того, следует вспомнить о внутримолекулярной энергии
. Кроме того, следует вспомнить о внутримолекулярной энергии 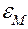 и внутриядерной энергии
и внутриядерной энергии 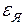 . Все эти виды энергии образуют внутреннюю энергию тела:
. Все эти виды энергии образуют внутреннюю энергию тела:
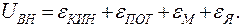 (9.4)
(9.4)
Если при движении тела на него действует сила трения, то тело нагревается, значит, увеличивается внутренняя кинетическая энергия. При деформации происходит сжатие или растяжение тела, следовательно, увеличивается или уменьшается внутренняя потенциальная энергия. Мы не будем изучать процессы высвобождения энергии в процессе химической реакции или ядерной реакции, поэтому можем пока опустить последние два вида энергии в формуле (9.4). Внутренней энергией будем называть сумму кинетической энергии движения молекул и потенциальной энергии их взаимодействия:
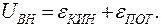 (9.5)
(9.5)
В системе молекул, образующих тело, могут происходить различные процессы. Нагреем сосуд с водой, сначала нагреется вода в нижней части сосуда, потом в результате теплообмена выровняется температура во всём объёме. Если в воду добавить несколько капель красителя, то будет происходить процесс диффузии, т.е. перенос массы до тех пор, пока цвет всего раствора не станет одинаковым. Если происходит движение жидкости, например, течение воды в реке, то в процесс движения вовлекаются не все слои, а идёт постепенное захватывание более нижних слоёв, при этом происходит передача импульса от одного слоя к другому. Всё это примеры неравновесных процессов, т.е. явлений переноса.
В равновесной термодинамике изучаются системы, пришедшие к состоянию равновесия. Нас не будет интересовать способ достижения состояния покоя, это будет предметом изучения в следующих разделах.
Дата добавления: 2019-09-30; просмотров: 918;











