Взаимодействие молекул
В зависимости от температуры вещество может находиться в газообразном, жидком или твердом состоянии. При высоких температурах, 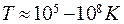 , происходит ионизация и вещество переходит в состояние плазмы. Плазма – частично или полностью ионизованный газ, в целом нейтральный, т. к. плотности положительных и отрицательных зарядов одинаковы.
, происходит ионизация и вещество переходит в состояние плазмы. Плазма – частично или полностью ионизованный газ, в целом нейтральный, т. к. плотности положительных и отрицательных зарядов одинаковы.
Для характеристики состояния вещества определяющую роль играет взаимодействие молекул. В идеальном газе взаимодействием молекул можно пренебречь. При увеличении плотности газа и температуры уже нельзя пренебречь процессами столкновения, поэтому необходимо учитывать размеры молекул и их взаимодействие. Молекулярное взаимодействие имеет электромагнитную и квантовую природу.
 При сближении на расстояние
При сближении на расстояние 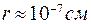 возникают силы притяжения, называемые ван – дер – ваальсовыми силами.
возникают силы притяжения, называемые ван – дер – ваальсовыми силами.
 Электрический диполь – система одинаковых по величине и противоположных по знаку зарядов, расположенных на расстоянии l. Дипольный электрический момент
Электрический диполь – система одинаковых по величине и противоположных по знаку зарядов, расположенных на расстоянии l. Дипольный электрический момент 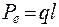 направлен от центра отрицательного к центру положительного заряда (рис. 8.5).
направлен от центра отрицательного к центру положительного заряда (рис. 8.5).
Если молекулы обладают дипольным электрическим моментом Pe, или более высокого порядка – квадрупольным Qe и т. д., то сила взаимодействия между молекулами называется ориентационной.
Поскольку молекула в целом нейтральна, то на большом расстоянии от центра молекулы электрическое поле равно нулю.
Потенциал системы зарядов:
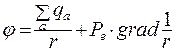 (8.14)
(8.14)
где r – расстояние от центра молекулы. Для нейтральной системы
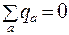 , тогда потенциал
, тогда потенциал 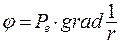 .
.
Найдем напряженность электрического поля:
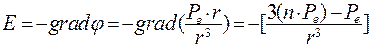 (8.15)
(8.15)
В направлении 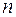 , перпендикулярном к оси диполя напряженность электрического поля:
, перпендикулярном к оси диполя напряженность электрического поля:
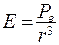 (8.16)
(8.16)
Электрическое поле молекулы действует на заряженные частицы соседней молекулы, что приводит к ориентации дипольных моментов. Сила взаимодействия двух диполей:
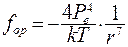 (8.17)
(8.17)
где r – расстояние между центрами молекул.
Молекулы, не обладающие дипольным моментом, деформируются в электрическом поле соседней молекулы, т. к. смещаются центры положительного и отрицательного зарядов. Между молекулами возникают индукционные силы:
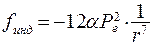 (8.18)
(8.18)
где a - поляризуемость молекулы.
Колебания электронов в молекуле возбуждают колебания электронов в другой молекуле. Когерентные колебания, происходящие с одинаковой частотой и в одинаковой фазе, приводят к дисперсному взаимодействию, которое характеризуется силой:
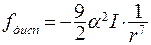 (8.19)
(8.19)
где I – потенциал ионизации молекулы.
При сближении молекул на расстояние 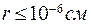 возникает квантовое обменное взаимодействие, приводящее к образованию химической связи или к отталкиванию:
возникает квантовое обменное взаимодействие, приводящее к образованию химической связи или к отталкиванию:
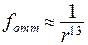 (8.20)
(8.20)
Результирующая сила:
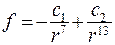 (8.21)
(8.21)
где постоянные 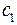 и
и 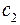 - характеристики, зависящие от поляризуемости и от потенциала ионизации молекул.
- характеристики, зависящие от поляризуемости и от потенциала ионизации молекул.
Энергия молекул складывается из кинетической энергии 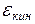 и потенциальной энергии взаимодействия eвз.:
и потенциальной энергии взаимодействия eвз.:
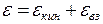 (8.22)
(8.22)
Пусть одна из молекул покоится. На значительном расстоянии от нее энергия движущейся молекулы равна кинетической энергии: 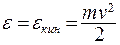 . При сближении молекул появляется потенциальная энергия:
. При сближении молекул появляется потенциальная энергия:
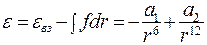 (8.23)
(8.23)
При движении в области потенциальной ямы возрастает скорость молекулы ( 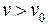 ) и кинетическая энергия
) и кинетическая энергия 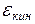 , но полная энергия системы молекул остается постоянной. При дальнейшем сближении начинается действие сил отталкивания. В состоянии равновесия энергия взаимодействия имеет минимальную величину.
, но полная энергия системы молекул остается постоянной. При дальнейшем сближении начинается действие сил отталкивания. В состоянии равновесия энергия взаимодействия имеет минимальную величину.
Минимальное расстояние сближения молекул называется эффективным диаметром молекулы: dэфф. (r > dэфф. – притяжение, r < dэфф. – отталкивание). Молекулярные силы не зависят от числа молекул, т.к. имеет значение воздействие на молекулу только ее ближайшего окружения, вследствие короткодействия молекулярных сил.
Дата добавления: 2019-09-30; просмотров: 695;











