Модель 3. Теплоизолированная незамкнутая система.
Система теплоизолирована от внешней среды: 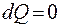 , но возможен обмен веществом со средой (рис. 9.3). Энтропия и внутренняя энергия системы могут изменяться.
, но возможен обмен веществом со средой (рис. 9.3). Энтропия и внутренняя энергия системы могут изменяться.
Модель 4. Открытая система.
В термодинамической системе возможен обмен энергией и веществом со средой, такая система является открытой (рис. 9.4). Все термодинамические функции: 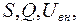 а также параметры P, V, T, n могут изменяться. Энтропия системы увеличивается, если в системе протекает необратимый процесс. Например, вещество диффундирует из области с большей концентрацией n1 в область с меньшей концентрацией n2
а также параметры P, V, T, n могут изменяться. Энтропия системы увеличивается, если в системе протекает необратимый процесс. Например, вещество диффундирует из области с большей концентрацией n1 в область с меньшей концентрацией n2
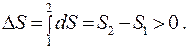
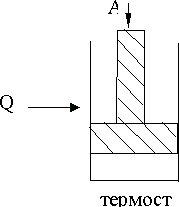
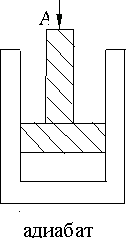
Рис. 9.1. Рис. 9.2.
В равновесной термодинамике изучаются установившиеся процессы в неизолированной замкнутой системе (модель 1) и в теплоизолированной замкнутой системе (модель 2). Равновесным, как известно, называется процесс, проходящий через ряд равновесных состояний. При медленном движении поршня (модель 1) газ в сосуде успевает придти в состояние однородной концентрации, а при медленном нагревании успевает выровняться температура во всех точках. С другой стороны, равновесным может считаться адиабатический процесс, который протекает так быстро, что не изменяется количество теплоты системы (модель 2).
Возможны различные виды равновесий: тепловое, механическое, равновесие концентраций.
| |
Если две системы находятся в тепловом равновесии с третьей системой, то они находятся в тепловом равновесии между собой, характеризующимся равенством температур во всех точках этих систем.
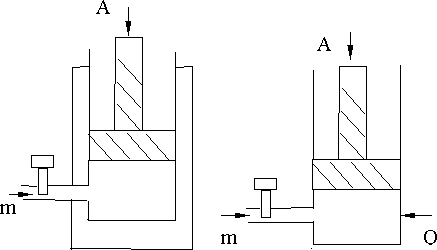
Рис. 9.3. Рис. 9.4.
Можно распространить «нулевой» закон на другие виды равновесия. Например, если дверь из кухни открыта в столовую, то аппетитный запах испечённого пирога распространится в столовой, а затем перейдёт в кабинет. Если концентрация ароматических веществ одинакова в кухне и столовой, а также в столовой и кабинете, то она будет одинаковой в кухне и кабинете. Термодинамическое стационарное состояние возникает, если постоянный поток вещества или энергии не прекращается.
Так, если пирог ещё печётся в духовке, то, начиная с момента готовности, запах будет постоянно доноситься из кухни, концентрация ароматических веществ будет нарастать. Если не доводить до крайности, когда пирог начнёт подгорать, этот пример можно рассматривать как иллюстрацию термодинамического стационарного состояния.
А вот ещё пример: в живой клетке постоянно происходит процесс обмена веществом и энергией с внешней средой (модель 4). Если количество поступающего в клетки вещества или энергии равно количеству отдаваемого во внешнюю среду, то наступает баланс массы или энергии.
Дата добавления: 2019-09-30; просмотров: 923;











