НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Направление самопроизвольного протекания ОВР определяется так же, как и у всех других реакций, – по знаку изменения свободной энергии Гиббса (ΔGхр). Если в результате реакции свободная энергия системы убывает, то такая реакция термодинамически разрешена (ΔGхр<0).
Для окислительно-восстановительных реакций существует взаимосвязь между изменением стандартной свободной энергии и электродвижущей силой
ΔG0хр = -nFΔЕ0. (9.2)
В этом уравнении n - число электронов, участвующих в ОВР, ΔЕ0 – стандартная ЭДС окислительно-восстановительной системы, F – число Фарадея. По физическому смыслу F – это заряд 1 моль электронов.
F = qeNa= 1,6∙10-19Кл ∙6.022∙1023моль-1= 96352Кл/моль 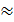 96500 Кл/моль = =26,8 А∙час/моль. Эту величину часто называют одним фарадеем.
96500 Кл/моль = =26,8 А∙час/моль. Эту величину часто называют одним фарадеем.
В уравнении 2.9 - n и F константы. Условие самопроизвольности реакции ΔG0хр < 0 означает, что окислительно-восстановительная реакция термодинамически разрешена, если ΔЕ > 0. В свою очередь ЭДС рассчитывается как разность потенциала окислителя и восстановителя ΔЕ= Еок – Eвосс > 0.
Из этого соотношения следует, что ОВР будет протекать самопроизвольно в прямом направлении, если Еок > Eвосс.
В качестве примера вернемся к ур.1.9 и определим по таблице значения стандартных электродных потенциалов полуреакций.
Sn2+ - 2  = Sn4+ Е0восс = +0,151 В
= Sn4+ Е0восс = +0,151 В
2 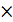 Fe3+ +
Fe3+ +  = Fe2+ Е0ок = +0,771 В
= Fe2+ Е0ок = +0,771 В
Sn2+ +2Fe3+ = Sn4+ + 2Fe2+
В данном примере ΔЕ= Еок – Eвосс = +0,771 – (+0,151) = +0,65В > 0, а Еок > Eвосс. Реакция 9.1 будет протекать в стандартных условиях самопроизвольно в прямом направлении.
Реальные ОВР начинают протекать самопроизвольно с заметной скоростью, если ЭДС системы превышает 0,4 В.
Дата добавления: 2021-01-26; просмотров: 514;











