Схема электролиза с растворимым анодом.
В качестве примера рассмотрим процесс гальванического нанесения меди на стальное изделие. Схема электролизера.
(-) Fe| Раствор CuSO4|Cu (+)
1. В водном растворе соль сульфата меди полностью диссоциирует на ионы CuSO4 → Cu2+ + SO42-, таким образом, в электролите присутствует три вида частиц, способных участвовать в электродных реакциях: молекулы Н2О, ионы Cu2+и SO42-
Металлическая медь, из которой сделан анод, также способна окисляться.
2,3. Возможные анодные реакции:
(+)An: Cu0 - 2 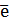 =Cu2+ E0= + 0,337 B (1)
=Cu2+ E0= + 0,337 B (1)
2 SO42- - 2 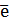 = S2O82- E0 = + 2,01 B (2)
= S2O82- E0 = + 2,01 B (2)
2 Н2О - 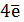 = O2 + 4H+ E0 = + 1,23 B (3)
= O2 + 4H+ E0 = + 1,23 B (3)
Возможные катодные реакции:
(-)Kat: Cu2+ + 2 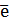 = Cu0 E0 = + 0,337 B (1)
= Cu0 E0 = + 0,337 B (1)
2Н2О + 2 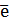 = H2 + 2OH- E0= - 0,82 B (2)
= H2 + 2OH- E0= - 0,82 B (2)
3. Сравнив потенциалы реакций, делаем вывод, что на аноде будет протекать реакция №1, так как ее потенциал наименьший, а на катоде − тоже реакция №1, так как ее потенциал наибольший.
5. Сложив эти уравнения, получим суммарную реакцию электролиза
ИМУ Cu0 + Cu2+ = Cu2+ + Cu0
МУ Cu0 + CuSO4 = CuSO4 + Cu0
Эта запись означает, что полученные при растворении (окислении) медного анода ионы меди Cu2+ под действием электрического поля мигрируют к железному катоду и восстанавливаются (осаждаются) на нем. В результате стальная деталь, являющаяся в электролизере катодом, покрывается слоем металлической меди.
Дата добавления: 2021-01-26; просмотров: 456;











