ЭЛЕМЕНТЫ ТЕХНИЧЕСКОЙ ЭЛЕКТРОХИМИИ
Химические источники тока
Химические источники тока подразделяются на первичные (не перезаряжаемые) и вторичные (перезаряжаемые). К первичным относятся гальванические элементы (ГЭ) и топливные элементы (ТЭ). Ко вторичным – аккумуляторы. Первичные источники тока - это устройства, в которых внутренняя энергия самопроизвольных необратимых окислительно-восстановительных реакций преобразуется в энергию электрического тока. В аккумуляторах используемые самопроизвольные ОВР имеют высокую степень обратимости. Рассмотрим их подробнее.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Согласно уравнению Нернста (ур.9.3) электродный потенциал можно существенно изменять либо за счет смены электродной реакции (Е0), либо за счет изменения концентрации потенциалопределяющих частиц (ln  ). В реальных устройствах с целью повышения ЭДС используют оба приема.
). В реальных устройствах с целью повышения ЭДС используют оба приема.
| V |
| R |

| Zn |
| Cu |
KCl
| ZnSO4 |
| CuSO4 |
Рис.9.2. Медно-цинковый гальванический элемент
Схема данного элемента может быть представлена в следующем виде:
(-)Zn/ ZnSO4// CuSO4/ Cu (+)
Каждая из вертикальных черт обозначает границу раздела
/ - металл-раствор, // - раствор-раствор.
На рис. 9.2 представлена схема стандартного медно-цинкового гальванического элемента (элемент Даниэля – Якоби).
Устройство состоит из двух полуэлементов: 1. Цинковая пластина опущена в 1М раствор ZnSO4; 2. Медная пластина – в 1М раствор CuSO4. В первом полуэлементе формируется скачок потенциала за счет равновесия между атомами
цинка в металле и ионами цинка в растворе Zn0 - 2  = Zn2+. Во втором - за счет реакции Cu0 - 2
= Zn2+. Во втором - за счет реакции Cu0 - 2  = Cu2+.
= Cu2+.
Так как потенциал первой реакции значительно отрицательнее, чем у второй, то на цинковом электроде пойдет процесс окисления (анод), а на медном – процесс восстановления (катод). Избыток образовавшихся электронов по внешней цепи с цинкового электрода пойдет на медный электрод.
Zn0 - 2  = Zn2+ Е0 = - 0,76 В
= Zn2+ Е0 = - 0,76 В
Cu2+ + 2  = Cu0 Е0 = +0,34В
= Cu0 Е0 = +0,34В
Zn0 + Cu2+ = Cu0 + Zn2+
Zn + CuSO4 = ZnSO4 + Cu - токообразующая реакция.
ΔЕ0 = Е0ок – E0восс = +0,34 – (-0,76) = +1,10 В – стандартная ЭДС.
Для повышения ЭДС можно изменить концентрацию потенциалопределяющих ионов. Увеличим концентрацию раствора CuSO4 до 2моль/л, а концентрацию раствора ZnSO4 снизим до 10-2моль/л. Расчет изменившихся потенциалов проведем по уравнению Нернста.
ЕCu = Е0Cu +  lg[Cu2+ ] = +0,34 + 0,0295lg 2 = +0,35В
lg[Cu2+ ] = +0,34 + 0,0295lg 2 = +0,35В
ЕZn = Е0Zn +  lg[Zn2+ ] = - 0,76 + 0,0295lg10-2 = - 0,82В
lg[Zn2+ ] = - 0,76 + 0,0295lg10-2 = - 0,82В
ΔЕ = ЕCu – EZn = +0,35 – (-0,82) = +1,17В. ЭДС увеличилась на 70 mB.
Промышленность выпускает огромное количество разнотипных ГЭ, которые являются одноразовыми устройствами и после завершения работы подлежат утилизации. Они имеют разные сферы применения, отличаются конструкцией, составом электролитов, габаритами и др. В большинстве выпускаемых гальванических элементов используется только один электролит, который включает в себя специальные загустители. ГЭ подразделяются на цилиндрические и дисковые.
ТОПЛИВНЫЕ ЭЛЕМЕНТЫ
В отличие от гальванических элементов, в которые реагенты реакции закладываются при изготовлении, топливные элементы представляют из себя электродные блоки, разделенные электролитными и реагентными камерами, в которые необходимые для реакции вещества подаются по мере необходимости, а продукты реакции отводятся. При необходимости отключить элемент подача реагентов прекращается. Теоретически такая система может работать бесконечно, однако на практике это не совсем так.
В качестве окислителя в большинстве ТЭ используется либо чистый кислород, либо кислород из воздуха. Набор восстановителей (топлива) более широк. Газообразный водород, гидразин, метанол, оксид углерода, углеводороды и др. Наиболее разработанными конструкциями являются водород – кислородные ТЭ. В зависимости от рабочей температуры различают низкотемпературные (до
1000С), среднетемпературные (до 3000С) и высокотемпературные (свыше 5000С) топливные элементы.
| (+) |
| (-) |
| Н2О |
| Н2О |
| Н2 |
| Электролит ра-р КОН |
| I |
| II |
| О2 |
Рис. 9.3. Схема водород-кислородного топливного элемента
Устройство состоит из трех камер, разделенных водородным (I) и кислородным электродами (II). Между электродами расположена камера для электролита (~25% раствор КОН) с разделительной мембраной (сепаратор). Электроды представляют из себя пористые блоки спеченного высокодисперсного карбонильного никеля. В кислородном электроде имеется добавка скелетного серебра. Давление подаваемых в ТЭ водорода и кислорода подбирается таким образом, чтобы уравновесить капиллярное давление электролита, проникающего в тело электродов. Внутри электродных блоков создается трехфазная реакционная
система ТВ/ГАЗ/Ж. Электроды, кроме роли токоотводов выполняют роль катализаторов, для протекающих реакций, снижая их энергию активации.
В процессе работы в водородном электроде идет реакция окисления газообразного водорода:
H2 + 2OH- - 2  =2H2O E0 = - 0,82B,
=2H2O E0 = - 0,82B,
а в кислородном электроде – реакция восстановления кислорода
O2 +2H2O + 4 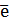 = 4OH- E0 = + 0,4B
= 4OH- E0 = + 0,4B
Суммарная токообразующая реакция, протекающая в ТЭ
2Н2 + O2 = 2H2O
Cтандартная ЭДС ТЭ ΔЕ = ЕО2 – EН2 = +0,4 – (-0,82) = +1,23В.
Образующиеся в результате реакции пары воды отводятся из ТЭ. При необходимости отключения устройства подача водорода и кислорода в ТЭ прекращается.
Топливные элементы являются основными узлами электрохимических генераторов (ЭХГ), которые включают в себя системы хранения и транспортировки реагентов и контрольно-измерительную аппаратуру.
Срок службы ТЭ, как правило, ограничен сроком службы электродов. В процессе эксплуатации вместе с реагентами в зону реакции попадают посторонние вещества. Некоторые из них оказываются каталитическими ядами. Их действие постепенно приводит к необратимому отравлению электродов-катализаторов и
снижает их каталитическую активность, что приводит к выходу из строя всей системы.
Применение ТЭ необычайно широко и имеет большие перспективы. Они используются в космосе, на подводных лодках, для питания автономных радиобуев, в качестве источника электроэнергии в электромобилях, в качестве мощных стационарных источников тока и др.
АККУМУЛЯТОРЫ
Аккумуляторы относятся к перезаряжаемым источникам тока. В них внутренняя энергия обратимых окислительно-восстановительных реакций непосредственно преобразуется в энергию постоянного электрического тока. Заряженный аккумулятор производит электроэнергию до тех пор, пока запасенные в нем в виде электродов активные вещества (активная масса) не израсходуются до определенных пределов. После чего аккумулятор переходит в разряженное состояние. Если подключить его к источнику постоянного тока, то электродные реакции начнут протекать в обратном направлении и продукты разряда (реакции) начнут превращаться в исходную активную массу.
Теоретически аккумулятор можно создать на базе любой обратимой окислительно-восстановительной реакции. Однако по техническим и экономическим причинам в качестве аккумуляторных используются такие реакции, в которых как исходные вещества, так и продукты реакции являются трудно растворимыми веществами. Это является важнейшим условием обратимости электродных процессов. Продукты разряда должны оставаться в теле электрода или в приэлектродном пространстве.
Только в этом случае при заряде аккумулятора они вновь сформируют активную массу в нужном месте (на электроде). Если продукты разряда являются растворимыми, то они будут диффундировать в объем электролита, что значительно снижает степень обратимости реакций.
В аккумуляторах не могут использоваться два электролита, так как невозможно полностью устранить их взаимную диффузию, а использование толстых межэлектродных диафрагм ведет к значительному увеличению внутреннего сопротивления аккумулятора. Все это уменьшает степень обратимости электродных реакций и снижает КПД. всего устройства.
В зависимости от типа электролита аккумуляторы делятся на кислотные и щелочные. В первых используются растворы серной кислоты (H2SO4), а во вторых растворы гидроксида калия (КOH).
Рассмотрим принцип работы устройства на примере кислотного свинцового аккумулятора.
| (+) |
| (-) |
| Электролит ра-р H2SO4 |
| I |
| II |
Рис. 9.4. Схема элементарной ячейки кислотного аккумулятора
Ячейка представляет собой емкость, заполненную 30% раствором серной кислоты, в который помещены отрицательный (I) и положительный (II) электроды, разделенные специальной мембраной (сепаратором). Основой обоих электродов является металлическая решетка из сплава свинец-сурьма (Pb-Sb), обладающая хорошей механической прочностью. Активной массой отрицательного электрода (анода) является свинцовая губка (вспененный свинец с большой удельной
поверхностью). Положительный электрод (катод) изготовлен из порошкообразной двуокиси свинца (PbO2), которая в виде мастики наносится на решетчатую основу, а затем отжигается. Оба электрода имеют очень развитую поверхность, что увеличивает рабочую плотность тока. Пленка сепаратора предотвращает короткие
замыкания между электродами и в набухшем состоянии уменьшает объем свободного электролита.
Схему аккумулятора можно представить следующим образом:
(+) Pb | H2SO4 | PbO2 (-)
Основной токообразующей реакцией является взаимодействие свинца с двуокисью свинца в кислой среде
МУ Pb + PbO2 + 2H2SO4 ↔ 2PbSO4↓+2H2O
ИМУ Pb + PbO2 + 4H+ + 2SO42- ↔ 2PbSO4↓+2H2O
В процессе разряда аккумулятора на его отрицательном электроде протекает реакция окисления свинца, а на положительном – реакция восстановления двуокиси свинца. В обоих процессах продуктом реакций является труднорастворимый сульфат свинца (PbSO4).
(-) Pb - 2  ↔ Pb2+ E0 = - 0,136 B
↔ Pb2+ E0 = - 0,136 B
(+) PbO2 + 4H+ + 2  ↔ Pb2+ + 2H2O E0 = + 1,45B
↔ Pb2+ + 2H2O E0 = + 1,45B
Образующиеся ионы свинца в приэлектродном слое взаимодействуют с сульфат-ионами, и на поверхности электродов образуется слой нерастворимой соли
Pb2++ SO42- → PbSO4↓
Из реакции видно, что в процессе разряда происходит связывание сульфат-ионов в нерастворимое соединение и образование молекул воды. Это приводит к снижению концентрации кислоты и уменьшению ЭДС аккумулятора. На практике часто о степени разряженности аккумулятора судят по плотности электролита. Чем меньше плотность, тем сильнее разряжено устройство.
При зарядке аккумуляторные клеммы подсоединяются к клеммам источника постоянного тока с соблюдением полярности. Сила зарядного тока выбирается из
расчета 10% от емкости аккумулятора. В процессе заряда все вышеперечисленные
реакции начинают протекать в обратном направлении. На отрицательных пластинах образуется свинец, а на положительных – двуокись свинца. Нарабатывается исходная активная масса. При истощении PbSO4 в порах электродов на них начинается процесс электролиза воды, сопровождаемый бурным выделением водорода и кислорода. Процесс зарядки считается законченным.
Свинцовые аккумуляторы выдерживают до 700 циклов разряд-заряд, имеют невысокую стоимость и срок службы до 5 лет. В то же время они имеют большую массу и высокий саморазряд при хранении.
Среди множества щелочных аккумуляторов следует выделить железо-никелевые, никель-кадмиевые и серебряно-цинковые системы. Первые используются в качестве тяговых для питания электрокаров и рудничных поездов,
вторые - позволяют реализовать герметичные конструкции и используются для питания электро - и радиоаппаратуры, а серебряно-цинковые обладают очень хорошими удельными характеристиками ( емкость на единицу веса), но в силу высокой стоимости используются только в специальной технике.
За последнее десятилетие появились принципиально новые аккумуляторы, в которых в качестве анодов используются высокоактивные щелочные металлы, а в качестве катодов сложные оксидные системы. Особняком стоят литий-ионные аккумуляторы. В них реализованы все достоинства литиевых систем, но исключается возгорание при попадании воздуха или влаги.
Электролиз
Электролизом называют окислительно-восстановительную реакцию, протекающую на электродах под действием постоянного электрического тока. При этом энергия тока превращается во внутреннюю энергию несамопроизволной ОВР.
Процессы электролиза осуществляются в устройствах, называемых «электролизеры», конструкция которых в каждом случае индивидуальна. Простейший электролизер представляет собой емкость, заполненную электролитом, в который опущены два электрода: анод (+) и катод (-). На аноде протекают реакции окисления, а на катоде – восстановления. Чтобы исключить взаимодействие анодных и катодных продуктов, электролизеры разделяются специальными диафрагмами, изготавливаемыми из керамики, пластмасс, асбеста и, в отдельных случаях, из ионообменных мембран.
Области применения процессов электролиза необычайно широки: получение высокоактивных металлов (электрометаллургия Al, Mg, Ti), получение металлических покрытий (гальванотехника), получение металлов высокой чистоты (электрорафинирование), получение неорганических и органических веществ (электросинтез), электрополировка металлов и многое другое.
Классификация процессов электролиза довольно затруднена, однако наиболее общей может служить разделение его на электролиз с растворимыми и электролиз с нерастворимыми анодами. В первом случае материал анода является участником электродных процессов, а во втором – токоподводом и катализатором.
В качестве нерастворимых анодов используются благородные металлы (Pt, Au), графит, всевозможные оксидные системы на основе марганца, свинца, рутения, титана и т.д.
В качестве катодов можно использовать любой из невосстанавливаемых материалов (графит, титан, сталь, медь, никель и др.).
Упрощенная схема электролизера может быть представлена в следующем виде:
(-) Катод | Электролит | Анод (+)
Для определения продуктов электродных процессов и самой окислительно-восстановительной реакции необходимо составить «схему электролиза». Она включает в себя несколько последовательных операций.
СХЕМА ЭЛЕКТРОЛИЗА
1. В системе необходимо определить все частицы, способные окисляться и восстанавливаться, включая электролит и вещество анода. Материал катода непосредственного участия в реакции не принимает.
2. Сделав допущение, что катионы под действием поля будут двигаться к катоду, анионы – к аноду, а нейтральные молекулы (например Н2О) - и к (-) и к (+), определить возможные реакции на катоде и на аноде.
3. Используя таблицы стандартных электродных потенциалов, где приведены электродные реакции, выбрать необходимые.
4. Сравнив электродные потенциалы реакций, установить очередность их протекания на электродах. На катоде первой будет идти реакция с наибольшим потенциалом, а на аноде - с наименьшим.
5. В выбранных реакциях при помощи коэффициентов уравнять число электронов и сложить эти реакции. Полученная реакция и будет той
несамопроизвольной ОВР, которая идет под действием электрического тока.
Дата добавления: 2021-01-26; просмотров: 448;











