Окислительно-восстановительные реакции ( оксидо-редуктазные)
В органической химии приняты несложные определения реакций окисления и восстановления.
Реакция окисления - изменяется состав вещества – добавляются атомы кислорода или удаляются атомы водорода.
Реакции восстановления – изменяется состав вещества – удаляются атомы водорода или добавляются атомы водорода..
К процессам окисления относятся превращения, сопровождающиеся внутримолекулярным дегидрированием ( обратный процесс гидрирование – восстановление)
А . С (sp3 ) ———> С (sp2 ) ———> С ( sp)
алкан алкен алкин последовательность
процессов окисления
Б. R– СН3 ———> R– СН2 – ОН ———> R– СН О
спирт альдегид
В. Окисление тиолов происходит как межмолекулярная реакция дегидрирования, сопровождается , в первую очередь, образованием дисульфидов.
2 R – SH + [ O ]———> R – S – S – R + НОН
тиол дисульфид
Реакция имеет большое значение в регуляции количества свободных SH групп и дисульфидных связей в белках. Окислители уменьшают содержание свободных тиольных групп, а восстановители - уменьшают число дисульфидных связей.
Тиольные группы в белках играют важную роль в выполнении белками ферментативных и других функций, например, активная форма гормона инсулина содержит две дисульфидные связи. Прикрепление внеклеточных белков к мембране клетки также может осуществляться с участием дисульфидных групп ( белок фибронектин).
В биохимических реакциях окисления и восстановления принимают участие ферменты – оксидоредуктазы. Белковые молекулы не могут осуществлять перенос электронов,
поэтому в составе ферментов обязательно присутствуют органические молекулы или катионы металлов, способные передавать электроны , то есть существовать в окисленной и восстановленной форм е ( витамин С , липоевая кислота, кофермент НАД+ / НАДН ,
ФАД / ФАДН2 , гем, содержащий ионы железа (+2) / ( +3), ионы меди ( +1) / ( +2 ) и др .)
Реакции окисления- дегидрирования- типичны для насыщенных атомов углерода,
гидрокси, тиольной и аминогрупп. Наиболее распространенным переносчиком атомов водорода является кофермент НАД+ в реакциях окисления и кофермент НАДН в реакциях восстановления( большинство реакций обратимы) .
Примеры.
Окисление этанола и других алкоголей алкогольдегидрогеназой – первый этап метаболизма экзогенных спиртов, попадающих в организм в составе лекарственных препаратов, алкогольных напитков.
Фермент алкогольдегидрогеназа
СН3 – СН2 – О – Н + НАД+ <————————> СН3 – СН= О + НАДН + Н +
этанол этаналь
Превращения молочной и пировиноградной кислот друг в друга происходит во всех тканях организма. В анаэробных ( бескислородных) условиях образование лактата – конечный этап метаболизма глюкозы. Присутствие кислорода снижает образование молочной кислоты и стимулирует ее окисление в пировиноградную, процесс весьма важен для сердечной мышцы, печени.
фермент лактатдегидрогеназа
СН3 –СН – СООН + НАД+ <————————> СН3 – С – СООН + НАДН + Н +
| | |
ОН О
2-гидроксипропановая кислота 2- оксопропановая кислота
молочная кислота ( лактат ) пировиноградная кислота( пируват)
Механизм реакции окисления с участием кофермента НАД +
Окисляемое вещество отдает два атома водорода, один – в виде иона гидрида, другой- в виде протона Атом углерода отдает два электрона химический связи атому водорода, который превращается в отрицательно заряженный анион – гидрид Н –.. Протон уходит из гидроксильной группы и оставляет два электрона связи. Эти да электрона образуют двойную связь.

Н Н –  гидрид- ион присоединяется к молекуле НАД + в положение 4
гидрид- ион присоединяется к молекуле НАД + в положение 4
СН3 – С- СООН + НАД +——> СН3 – С- СООН + НАДН + Н+
| | |
О •• Н О
 Н+
Н+
Протон переходит в раствор
Оставшаяся пара электронов образует двойную связь.
Кофермент НАД + принимает только один отрицательно заряженный ион гидрида, превращается в НАДН , а протон остается в растворе

удаляется
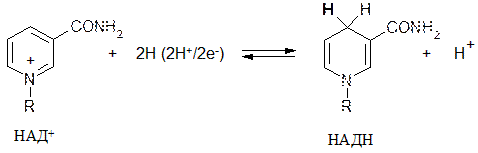
Восстановленная форма НАДН является неустойчивой, поскольку в пиридиновом цикле
исчезает ароматический секстет и единая пи-электронная система. Атом углерода в положении-4 имеет тетраэдрическое строение. Именно вновь присоединенный( в виде гидрида Н–) атом водорода( он выделен жирным шрифтом) затем удаляется при окислении восстановленной формы НАДН и передается следующему окислителю( это называется « молекулярная память» ) и до образования конечных продуктов обмена ( молочная кислота в анаэробных условиях или вода в аэробных условиях)
НАДН +Н++ Х ——>НАД ++ Х-Н
ПРИЛОЖЕНИЕ 1
Среди веществ, производящих раздражающее действие на организм человека, имеется большая группа соединений- лакриматоров( lacrima – лат. – слеза). Их используют в качестве защитных или боевых средств. Одним из самых простых соединений является хлористый бензил( фенилхлорметан).
СН2 –С1 СН2 – ОН + НС1
| + НОН ————> |


хлористый бензил бензиловый спирт
При попадании в глаз, на слизистые оболочки носа, рта быстро проходит гидролиз , выделяющийся хлороводород вызывает сильное слезотечение. Промежуточный карбокатион, образующийся в реакции, устойчив, стабилизирован сопряжением с ароматической электронной системой, реакция протекает по механизму S N 1 . В одинаковых условиях скорость реакции в 99 раз больше по сравнению с хлорэтаном. Обратите внимание, что замещение галогена в хлорбензоле ( хлорбензол + NаОН ) проходит в очень жестких условиях благодаря +М эффекту , который проявляет атомом хлора, в результате чего образуется единая сопряженная система.
ПРИЛОЖЕНИЕ 2 .
Липоевая кислота , содержащая две тиольные группы, необходима для нормального прохождения реакций цикла Кребса во всех аэробных тканях организма, высокое соднржание отмечено в печени, миокарде, почках. Используют как лекарственный препарат в профилактических целях и при заболеваниях: атеросклерозе, гепатитах, диабете, ожирении.
8 7 6 1
СН2 – СН2 –СН – (СН2 )4– СООН 8 7 6 1
| | + ФАД <————> СН2 – СН2 –СН – (СН2 )4– СООН
SH SH | |
S ——— S + ФАДН2
Дигидролипоевая кислота Дегидролипоевая кислота
восстановленная форма - окисленная форма -
6,8- димеркаптооктановая кислота циклический
Для проверки усвоения темы рекомендуем выполнить задания:
1. Сравните устойчивость двух промежуточных карбокатионов , которые могут
образоваться при гидратации кротоновой кислоты ( 2 - бутеновой кислоты ). Назовите механизм реакции. Соответствует ли строение получаемой 3-гидроксибутановой кислоты представлению о механизме реакции ?
2. Известно. что в организме человека происходит окисление аминокислоты цистеина
( 2-амино-3-меркаптопропановой кислоты) и образование аминокислоты цистина, которая хуже, чем цистеин, растворима в воде и может кристаллизоваться при болезни цистинурии в мочевом пузыре. Запишите уравнение реакции окисления цистеина.
3. Пара соединений: восстановленная форма гидрохинон ( 1,4- дигидроксибензол) и его окисленная форма хинон, участвуют в переносе электронов во внутренней мембране митохондрий при синтезе АТФ в аэробных условиях. Напишите формулы названных веществ.
4. Назовите механизм реакции образования медиатора ацетилхолина:
АцетилКоА+ холин ————> ацетилхолин + КоА
Напишите формулы трех выделенных соединений.
5. Назовите механизм реакции и запишите уравнение реакции гидролиза
ацетилхолина.
6. Сравните активность пировиноградной кислоты и уксусного альдегида при
взаимодействии с циановодородом. Запишите уравнения и назовите механизм реакции
7. Строение азометина С6Н5 – СН = N – C6 H5Напишите реакцию образования этого соединения. Назовите механизм реакции. Какой витамин образует основания Шиффа в процессе ферментативного катализа?.
ЛЕКЦИЯ 5
Дата добавления: 2019-05-21; просмотров: 721;











