ВЫЧИСЛЕНИЕ ТЕПЛОТ ОБРАЗОВАНИЯ
Теплоты образования молекул являются фундаментальными термохимическими величинами. Однако их значение для многих органических соединений неизвестны, поэтому квантовохимические расчеты этих величин представляют большой интерес с точки зрения органической химии.
Параметры полуэмпирических методов МЧПДП/3 и МПДП подобраны так, чтобы наилучшим образом воспроизвести экспериментальные теплоты образования органических соединений при нормальных условиях. Средняя ошибка при вычислении теплот образования молекул методом МЧПДП/3 составляет 38 кДж/моль, а методом МПДП — 25 кДж/моль [37].
Сложнее вычислить теплоты образования и теплоты атомизации молекул неэмпирическими методами. Даже для небольших молекул неэмпирический расчет в базисе 6-31ГФ* приводит к ошибкам в теплотах образования, превышающим 100 кДж/моль. Это связано с неполнотой использованного базиса и неучетом энергии электронной корреляции. С увеличением размера молекулы ошибки в неэмпирически вычисленных теплотах образования хотя и возрастают, но в значительной степени носят систематический характер. Поэтому их можно уменьшить с помощью коррекции конечных результатов по аддитивной схеме. Если предположить, что при образовании молекул из атомов ошибки вследствие неполноты использованного базиса и пренебрежения электронной корреляцией одинаковы для всех молекул, то при вычислении энергий атомизации ЕА можно воспользоваться следующей формулой:
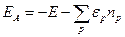
где Е — полная энергия молекулы, вычисленная неэмпирическим методом;
np — число атомов с номером р (р — номер атома в периодической системе элементов)
в молекуле; εр — эмпирический (корректирующий) параметр для атома с номером р; сумма берется по всем атомам с номерами р, из которых состоит молекула. В корректирующие инкременты можно включить также энергию нулевых колебаний.
Таблица 1.4 Экспериментальные теплоты образования и ошибки при вычислении этих величин квантовохнмнческимн методами (кДж/моль)
| Молекула | Экспериментальная величина НА | Ошибка при вычислении методом | ||
| 3-21ГФ | 6-31ГФ* | МПДП | ||
| Метан | -75 | -4 | ||
| Этан | -85 | |||
| Пропан | -104 | |||
| Этилен | -52 | -7 | -10 | |
| Пропилен | -10 | |||
| цис-Бутен-2 | -8 | — | -9 | |
| транс-Бутен-2 | -13 | -13 | -9 | |
| Н2С=СМе2 | -18 | -16 | ||
| Н2С=С=СН2 | -11 | -29 | -8 | |
| Н2С=СН-СН=СН2 | -20 | |||
| С2Н2 | -7 | -33 | ||
| CH3C≡CH | -25 | -15 | ||
| CH3C≡CСН3 | -44 | |||
| НС≡С-С≡СН | -46 | |||
| Циклопропан | -35 | -10 | -6 | |
| Циклопропен | -77 | -44 | ||
| Циклобутен | -47 | -34 | -26 | |
| Бензол | -11 | |||
| Н2О | -243 | -20 | -11 | -14 |
| Н2О2 | -136 | -24 | ||
| СО | -111 | |||
| СО2 | -395 | |||
| СН3ОН | -202 | -21 | -39 | |
| С2Н5ОН | -236 | -20 | -29 | |
| СН2О | -109 | -29 | ||
| НСООН | -381 | -54 | -8 | |
| CH3CHO | -167 | -11 | ||
| CH3COCH3 | -218 | -32 | ||
| CH3OCH3 | -185 | -44 | -30 | |
| NH3 | -46 | -4 | -17 | |
| N2H4 | -8 | -36 | ||
| цис-HN=NH | -33 | -16 | -72 | |
| HN3 | -72 | |||
| CH3NH2 | -23 | -8 | ||
| CH3NНCH3 | -18 | -9 | ||
| HCN | ||||
| CH3CN | -8 | |||
| СН3NС | — | |||
| N≡C—C≡N | -33 | |||
| HNO2 | -79 | -15 | — | -92 |
| N2O | -64 | -16 | ||
| Средняя ошибка |
При расчете теплот образования методами 3-21 ГФ и 6-31 ГФ* использованы корректирующие параметры из табл. 1.5.
Аналогичные корректирующие параметры могут быть подобраны для вычисления теплот образования молекул при нормальных условиях: 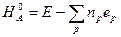
где eр - соответствующий эмпирический корректирующий параметр (поправка).
Расчеты с эмпирически подобранными значениями параметров ep показали, что с их помощью можно уменьшить ошибку в вычислении теплот образования органических молекул: при использовании базиса ОСТ-3 ГФ — до 45 кДж/моль, а при использовании базисов 3-21ГФ и 6-31ГФ* — соответственно до 29 и 25 кДж/моль (табл. 1.4). Значения поправок еp приведены в табл. 1.5.
Таблица 1.5Корректирующие параметры ер (ат.ед1.) для расчета теплот образования молекул неэмпирическими методами [37]
| Aтом | Метод | ||
| ОСТ-ЗГФ | 3-21 ГФ | 6-31ГФ* | |
| H С N О | -0,57429 -37,40983 -53,74645 -73,77352 | -0,56908 -37,67347 -54,14898 -74,36308 | -0,56912 -37,88940 -54,46617 -74,78492 |
1 1 ат.ед,= 2626 кДж/моль.
Дальнейшего повышения точности расчета можно достигнуть при использовании корректирующих параметров еp, которые зависят не только от типа атома, но и его ближайшего окружения. Так, в работе [38] корректирующие параметры подобраны для атомов H, С, N и О, причем значение eH для атома водорода зависит от того, с каким атомом этот водород валентно связан: [еH= 0,57171 (связь с атомом С), 0,56524 (связь с атомом N) и 0,56524 (связь с атомом О), eC=37,883, eN=54,472 и eO=74,800 атомных единиц для расчетов в базисе 6-31ГФ*]. Из этих данных видно, что численные значения еН для атомов водорода, валентно-связанных с атомами углерода, азота и кислорода, различаются на 0,02 ат.ед., или 50 кДж/моль.
Такие поправки нельзя использовать при расчете поверхностей потенциальной энергии, так как в ходе реакции всегда образуются структуры, в которых одни связи частично разорваны, а другие частично образованы, и нельзя сказать, между какими атомами есть валентная связь, а между какими ее нет. Однако поправки такого типа можно использовать для расчета тепловых эффектов реакций и для решения многих других прикладных задач.
Дата добавления: 2020-12-11; просмотров: 468;











