Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
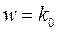 (2.1.5)
(2.1.5)
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Это характерно для тех процессов, скорость которых меньше скорости доставки реагирующих веществ к месту поведения реакции. Часто это имеет место в гетерогенных реакциях, идущих на поверхности раздела фаз.
По нулевому порядку идут и реакции, скорость которых лимитируется подачей энергии, необходимой для активации реагирующих молекул (например, фотохимические реакции, где определяющим фактором служит, например, количество поглощенного света, а не концентрация вещества). Кроме того, часто в каталитических реакциях скорость определяется концентрацией катализатора (фермента) и не зависит от концентрации реагирующих веществ.
Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка
А ––> В.
Реакции первого порядка характеризуются кинетическим уравнением вида
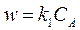 (2.1.6)
(2.1.6)
Уравнением первого порядка могут описываться скорости элементарных мономолекулярных реакций (изомеризация, термическое разложение и др.), а также реакции с более сложным механизмом, например, гидролиз сахарозы с образованием глюкозы и фруктозы. Эта реакция бимолекулярная, однако, из-за наличия большого избытка воды скорость зависит только от концентрации сахарозы.
Дата добавления: 2020-10-01; просмотров: 582;











