Скорость химической реакции
Основное понятие химической кинетики – скорость химической реакции. Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Математически определение средней скорости реакции Vср в интервале времени Δt записывается следующим образом:
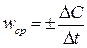 (2.1.1)
(2.1.1)
Скорость в химии – величина скалярная, является положительной, отношение же 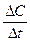 может быть как положительным, таки отрицательным, в зависимости от того, рассчитывается ли DС по исходным веществам или продуктам. Очевидно, что концентрации исходных веществ во времени уменьшаются (ΔСисх < 0), а концентрации продуктов реакции увеличиваются (ΔСпрод > 0). Поэтому при расчете по исходным веществам в уравнении (2.1.1) выбирается минус, а по продуктам – плюс.
может быть как положительным, таки отрицательным, в зависимости от того, рассчитывается ли DС по исходным веществам или продуктам. Очевидно, что концентрации исходных веществ во времени уменьшаются (ΔСисх < 0), а концентрации продуктов реакции увеличиваются (ΔСпрод > 0). Поэтому при расчете по исходным веществам в уравнении (2.1.1) выбирается минус, а по продуктам – плюс.
Истинная (или мгновенная) скорость реакции определяется как производная концентрации по времени:
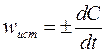 (2.1.2)
(2.1.2)
Графическое изображение зависимости концентрации реагентов от времени называется кинетической кривой (рис. 2.1.1).
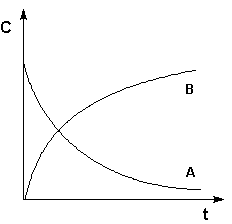
Рис. 2.1.1Кинетические кривые для исходных веществ (А) и продуктов реакции (В)
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.1.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной (угловому коэффициенту в данной точке):
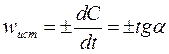
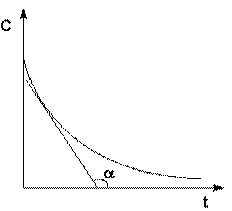
Рис. 2.1.2. Графическое определение wист
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции
2Н2 + О2 ––> 2Н2О
концентрации водорода, кислорода и воды изменяются в различной степени. Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
Основной постулат химической кинетики ‒ закон действия масс
В основе химической кинетики лежит основной постулат химической кинетики: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции аА + bВ + ... ––> продукты можно записать:
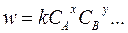 (2.1.3)
(2.1.3)
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Константа скорости зависит от природы реагирующих веществ, и от условий проведения реакции – температуры, катализатора и т.д.
Зависимость скорости реакции от концентраций реагирующих веществ (уравнение 2.1.3) определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (2.1.3) соответственно x и y) есть частный порядок реакции по компонентам А и В соответственно. Сумма показателей степени в кинетическом уравнении химической реакции (2.1.3) представляет собой общий порядок реакции n
n = x + y + …
Следует подчеркнуть, что порядок реакции определяется из экспериментальных данных и не связан в общем случае со стехиометрическими коэффициентами реагирующих веществ в уравнении реакции.
Вместе с тем, для элементарных реакций (т.е. реакций, идущих в одну стадию) показатели степени в кинетическом уравнении часто совпадают со стехиометрическими коэффициентами реагирующих веществ:
n= a+b+ … , и 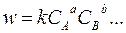 (2.1.4)
(2.1.4)
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим кинетические уравнения различных порядков.
Дата добавления: 2020-10-01; просмотров: 660;











