Примеры активных центров некоторых ферментов
Остановимся на ферментах класса гидролаз, для большинства которых идентифицированы группы, составляющие каталитически активные центры, и созданы обоснованные представления о взаимодействии этих групп в механизме каталитического цикла.
По структуре активных центров и механизму действия гидролазы условно можно разделить на 4 основных типа.
1. Гидролазы, содержащие в активном центре аспарагиновую или глутаминовую кислоту (лизоцим-пепсиновый тип).
2. Гидролазы, содержащие в активном центре гидроксильную группу серина, треонина или цистеина и цепь переноса протонов, активирующую эту группу (тип химотрипсина); гидролазы, использующие имидазольную группу гистидина непосредственно для активации воды (тип панкреатической рибонуклеазы).
3. Гидролазы, использующие комплексы Zn2+ или Со2+ для активации воды и субстрата (тип щелочной фосфатазы, карбоксипептидазы А).
4. Гидролазы, использующие ионы Мg2+ или Мn2+ для активации воды и субстрата (тип пирофосфатазы).
Химотрипсин.В активный центр входят Ser-195, His-57, Asp-102.
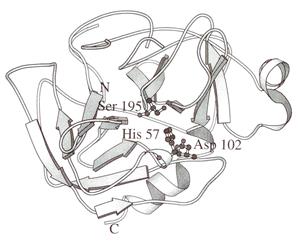
Рис. 1.5.4. Структура химотрипсина
Лактатдегидрогеназа. Это NAD+-зависимая дегидрогеназа. Осуществляет обратимое окисление-восстановление органических молекул, при этом в качестве донора (акцептора) гидрид-иона выступает кофермент. Каталитически активные группы фермента представлены Arg-165, His-194, Arg-105. Все эти аминокислоты являются консервативными. Молочная или пировиноградная кислоты фиксируются в активном центре с помощью положительного заряда Arg-168. Участниками каталитического процесса являются протон-транспортная цепь His-194-Asp-165 и Arg-105.
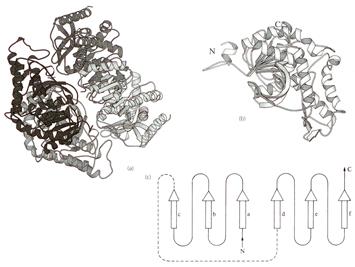
Рис. 1.5.5. Структура лактатдегидрогеназы
(а) Схематическое изображение тетрамера и (b) - отдельной субъединицы; (с) Модель NAD+-связывающего региона. Никотинамидное кольцо NAD+ связывается между цепями d и е, а адениновое кольцо – между а и b.
На рис. 1.5.6. приведены возможные типы связей, участвующих в присоединении NAD+ в активном центре ЛДГ.
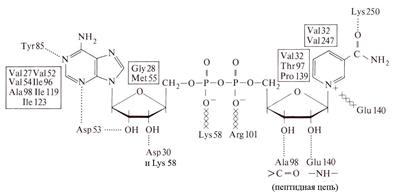
Рис. 1.5.6. Связывание NAD+ лактатдегидрогеназой
Линии, показанные точками – водородные связи, перекрестные линии – электростатические взаимодействия, аминокислотные остатки в рамках – гидрофобные взаимодействия
Триозофосфатизомераза. Каталитически важные группировки активного центра фермента представлены Glu-165 и His-95.
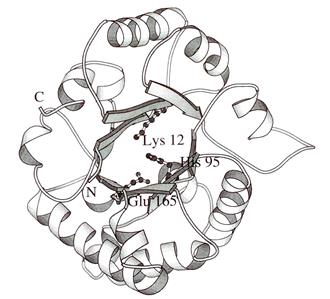
Рис. 1.5.7. Структура субъединицы триозофосфатизомеразы дрожжей
Дата добавления: 2020-10-01; просмотров: 589;











