Уравнение Михаэлиса-Ментен
Впервые А. Браун (Brown A.J.) и затем В.Анри (Henri V.) в начале ХХ века высказали предположение о том, что в основе ферментативной реакции лежит обратимое взаимодействис субстрата с ферментом с образованием комплекса, который далее распадается с образованием продуктов реакции и регенерацией исходного фермента. Эта гипотеза была далее развита в работах Михаэлиса (L. Michaelis) и Ментен (M.L. Menten) (1913 г.) и позднее – Бригсом (G.E. Briggs) и Холденом (J.B.S. Haldane) (1925 г.).
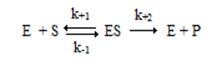
Кинетическую схему простейшей односторонней ферментативной реакции превращения одного субстрата в продукт можно представить следующим образом:
 (1)
(1)
Ферментативная реакция протекает в два этапа. На первом этапе фермент и субстрат образуют фермент-субстратный комплекс ES. Этот этап является быстрым и обратимым, он не сопровождается какими-либо химическими изменениями субстрата. Константы скорости реакции образования фермент-субстратного комплекса и обратного его распада равны соответственно k+1 и k-1. В образовании фермент-субстратного комплекса (ФСК, комплекс Михаэлиса) принимают участие нековалентные взаимодействия.
Каталитический процесс осуществляется на втором этапе реакции с константой первого порядка k+2 (kcat, число оборотов фермента). Комплекс Михаэлиса распадается с образованием конечного продукта реакции Р и регенерацией исходного фермента. Распад фермент-субстратного комплекса может происходить по-разному: в данной кинетической схеме он распадается в одну стадию, но в других случаях этих стадий может быть несколько.
Исходя из уравнения (1), можно расписать уравнения для скоростей отдельных стадий реакции.
Скорость образования фермент-субстратного комплекса:
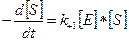 .
.
Скорость обратной реакции (диссоциации комплекса на исходные вещества):
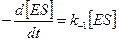 .
.
Скорость распада комплекса ES с образованием продуктов реакции и регенерацией фермента:
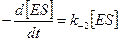 .
.
Стационарное течение процесса возможно тогда, когда концентрация субстрата существенно превосходит концентрацию фермента ([S]>> [E]). В этом случае распад комплекса ES по реакциям (+2) и (-1) уравновешивается его образованием по реакции (+1). Поэтому для условия стационарности можно записать:
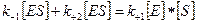
или
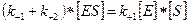 .
.
Обозначив общую концентрацию фермента через [E]0, при условии, что [E]0 = [E] + [ES], преобразуем предыдущее уравнение
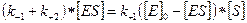 .
.
Откуда концентрация фермент-субстратного комплекса будет равна
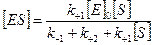 .
.
Обозначив
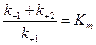 ,
,
Получим
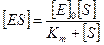 .
.
Скорость ферментативной реакции, измеряемая согласно схеме (1) по образованию продукта реакции Р из комплекса ES, может быть выражена следующим образом
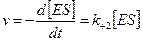 .
.
Подставляя в это выражение найденное значение [ES], получим
|
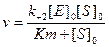
Данное уравнение отражает зависимость скорости ферментативной реакции от концентрации фермента и субстрата. Константа Км носит название константы Михаэлиса и имеет размерность концентрации субстрата. Уравнение (2) свидетельствует, что зависимость скорости ферментативной реакции от концентрации субстрата при [E]0=const является гиперболической функцией (рис. 2.2.1).
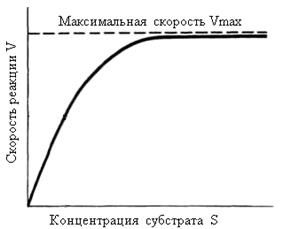
Рис.2.2.1. Зависимость скорости ферментативной реакции от концентрации субстрата
Кривая представляет собой равнобочную гиперболу. При достаточно малых концентрациях субстрата, когда [S] << Км, можно принять, что Км + [S] ≈ Км и тогда
V = k+2[E]0, [S]/ Км,
поэтому реакция имеет первый порядок по отношению к субстрату и является линейной функцией концентрации субстрата.
Когда [S] = Км, скорость реакции является полумаксимальной, т.е. v= 1/2 Vmax. В области высоких значений концентрации субстрата, когда [S] >> Км, можно принять, что Км + [S] ≈ [S], и тогда
v ≈ k+2[E]0 = Vmax,
а реакция имеет нулевой порядок по отношению к субстрату. Следовательно, при достижении определенной концентрации субстрата скорость ферментативной реакции достигает максимального значения Vmax и при дальнейшем увеличении концентрации субстрата не изменяется.
Смысл такого рода зависимости очевиден: скорость ферментативной реакции определяется в целом концентрацией фермент-субстратного комплекса и при малых концентрациях субстрата концентрация комплекса Михаэлиса пропорциональна [S], тогда как при избытке субстрата фактически весь фермент находится в форме ES. Дальнейшее повышение концентрации субстрата не приводит к увеличению [ES].
С учетом приведенного выше выражения, окончательное уравнение зависимости скорости ферментативной реакции от концентрации фермента и субстрата приобретает вид
|
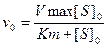 .
.
Уравнение (3) является фундаментальным уравнением ферментативной кинетики и обычно называется уравнением Михаэлиса-Ментен.
Скорость реакции приближается к максимальной достаточно медленно, и даже при [S]= 10Км, величина скорости достигает только 0,91 Vmax. В связи с этим значение максимальной скорости очень часто трудно измерить и его приходится рассчитывать из скоростей, наблюдаемых при концентрациях субстрата ниже насыщающих.
Согласно уравнения (3), скорость реакции при данной концентрации субстрата линейно зависит от концентрации фермента. В случае значительного числа ферментативных реакций это наблюдается в действительности. На рис. 2.2.2 приведен пример зависимости скорости ферментативной реакции от концентрации фермента.
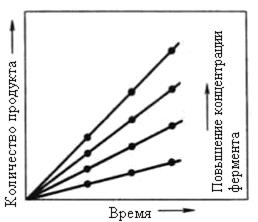
Рис. 2.2.2. Зависимость скорости от концентрации фермента
Линейный характер этой зависимости, наблюдающийся в достаточно широком интервале [E]0, не будет меняться до тех пор, пока соблюдаются условие существенного превышения концентрации субстрата над концентрацией фермента. При значительном повышении концентрации фермента будет наблюдаться отклонение от линейной зависимости и при некоторой концентрации фермента дальнейшего повышения скорости реакции происходить не будет, что обусловлено отсутствием достаточного количества свободного субстрата. В связи с этим при изучении влияния различных концентраций фермента необходимо, как и всегда, определять начальную скорость ферментативной реакции, когда глубина превращения субстрата незначительна и его концентрация остается достаточно высокой (соблюдается условие [S]>> [E]0).
В тех же случаях когда при соблюдении условия [S]>> [E]0 не наблюдается линейной зависимости между скоростью реакции и общей концентрацией фермента, для описания кинетики фермента нельзя применять уравнение Михаэлиса-Ментен.
Дата добавления: 2020-10-01; просмотров: 705;











