Уравнения Вант-Гоффа и Аррениуса.
Константа скорости реакции k в уравнении (2.1.3) есть функция температуры; повышение температуры, как правило, увеличивает константу скорости. Первая попытка учесть влияние температуры была сделана Вант-Гоффом, сформулировавшим следующее эмпирическое (т.е. на основе экспериментальных данных) правило: При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
Величина, показывающая, во сколько раз увеличивается константа скорости при повышении температуры на 10 градусов, есть температурный коэффициент Вант-Гоффа (γ). Математически правило Вант-Гоффа можно записать следующим образом:
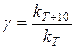 (2.1.17)
(2.1.17)
или
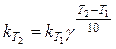 (2.1.18)
(2.1.18)
Правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).
Взаимодействие частиц осуществляется при их столкновениях; однако не каждое столкновение приводит к химическому взаимодействию частиц. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации. Энергия активации ЕА – необходимый избыток энергии (по сравнению со средней энергией реагирующих веществ), которым должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Рассмотрим путь некоторой элементарной реакции
А ––> В
Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом:
А ––> K# ––> B
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер (рис.2.1.5). Энергия активации реакции равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е'А выше, нежели энергия активации прямой реакции EA. Для эндотермической реакции наблюдается обратное соотношение между Е'А и Е'А. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции – тепловой эффект реакции (DU на рис 2.1.5.).
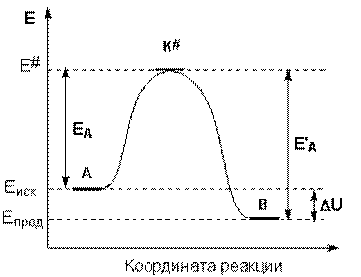
Рис. 2.1.5. Энергетический профиль химической реакции. Eисх – средняя энергия частиц исходных веществ, Eпрод – средняя энергия частиц продуктов реакции.
Поскольку температура – мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции.
Зависимость константы скорости от температуры описывается уравнением Аррениуса:
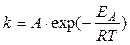 (2.1.19)
(2.1.19)
Здесь A – предэкспоненциальный множитель. Из уравнения (2.1.19) нетрудно показать его физический смысл: величина А равна константе скорости реакции при температуре, стремящейся к бесконечности.
Прологарифмируем соотношение (2.1.19):
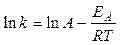
Как видно из последнего выражения, логарифм константы скорости линейно зависит от обратной температуры; величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (соответственно тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат, рис.2.1.6).
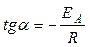
Рис.2.1.6.Зависимость логарифма константы скорости химической реакции от обратной температуры.
Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
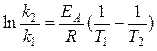
Катализ
Скорость химической реакции при данной температуре определяется скоростью образования активированного комплекса, которая, в свою очередь, зависит от величины энергии активации. Во многих химических реакциях в структуру активированного комплекса могут входить вещества, не являющиеся реагентами по уравнению реакции; очевидно, что в этом случае изменяется и величина энергии активации процесса. В случае наличия нескольких переходных состояний реакция будет идти в основном по пути с наименьшим активационным барьером.
Катализ – явление изменения скорости химической реакции в присутствии веществ, состояние и количество которых после реакции остаются неизменными.
Различают положительный и отрицательный катализ (соответственно увеличение и уменьшение скорости реакции), хотя часто под термином «катализ» подразумевают только положительный катализ; отрицательный же катализ называют ингибированием.
Вещество, входящее в структуру активированного комплекса, но не являющееся реагентом, называется катализатором. Для всех катализаторов характерны такие общие свойства, как специфичность и селективность действия.
Специфичность катализатора заключается в его способности ускорять только одну реакцию или группу однотипных реакций и не влиять на скорость других реакций. Так, например, многие переходные металлы (платина, медь, никель, железо и т.д.) являются катализаторами для процессов гидрирования; оксид алюминия катализирует реакции гидратации и т.д.
Селективность катализатора – способность ускорять одну из возможных при данных условиях параллельных реакций. Благодаря этому можно, применяя различные катализаторы, из одних и тех же исходных веществ получать различные продукты. В следующей таблице катализаторы реакций приведены слева в скобках, а реакции, которые они ускоряют - правее:
| [Cu]: СО + 2Н2 ––> СН3ОН | [Al2О3]: С2Н5ОН ––> С2Н4 + Н2О |
| [Ni]: СО + 2Н2 ––> СН4 + Н2О | [Cu]: С2Н5ОН ––> СН3СНО + Н2 |
Причиной увеличения скорости реакции при положительном катализе является уменьшение энергии активации при протекании реакции с участием катализатора (рис. 2.1.7). На этом рисунке приведено сравнение энергетических профилей реакции с катализатором и без катализатора. Катализатор снижает энергию активации и направляет реакцию по другому пути, как минимум, с образованием двух переходных состояний (соответствующих двум максимумам на энергетическом профиле реакции с катализатором). Если переходные состояния характеризуются более низкой энергией активации (ЕА,к) по сравнению с реакцией в отсутствии катализатора (ЕА), то альтернативная реакция протекает с более высокой скоростью, несмотря на образование большего числа промежуточных продуктов.

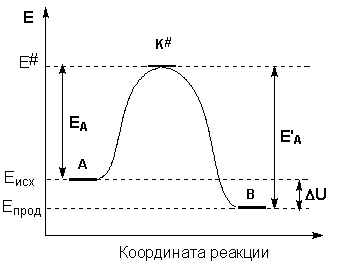
Рис.2.1.7.Сравнениеэнергетических профилей реакций без катализатора (сплошная линия) и с катализатором (пунктирная линия)
Утверждение о том, что катализатор снижает энергию активации, строго говоря, не корректно, так как реакция в присутствии катализатора не идентична исходной реакции. Это совершенно иной путь реакции, имеющий более низкий активационный барьер.
Поскольку, согласно уравнению Аррениуса (2.1.19), константа скорости химической реакции находится в экспоненциальной зависимости от величины энергии активации, уменьшение последней вызывает значительное увеличение константы скорости.
Необходимо отметить, что наличие катализатора не влияет на величину изменения термодинамического потенциала (ΔG или ΔF) в результате процесса и, следовательно, никакой катализатор не может сделать возможным самопроизвольное протекание термодинамически невозможного процесса (ΔG или ΔF которого больше нуля). Катализатор не изменяет величину константы равновесия для обратимых реакций; влияние катализатора в этом случае заключается только в ускорении достижения равновесного состояния, т.е. увеличения скоростей прямой и обратной реакций.
В зависимости от фазового состояния реагентов и катализатора, различают гомогенный и гетерогенный катализ. Гомогенный катализ – каталитические реакции, в которых реагенты и катализатор находятся в одной фазе. Наиболее распространенным типом гомогенного катализа является кислотный катализ, при котором в роли катализатора выступают ионы водорода Н+. Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами. Механизм гетерогенно-каталитических процессов значительно более сложен, чем в случае гомогенного катализа.
ЛЕКЦИЯ 2.2.
Дата добавления: 2020-10-01; просмотров: 759;











