Отдельные представители
Гликолевая кислота (гидроксиуксусная кислота) HOCH2 – COOH является простейшей гидроксикислотой. Хорошо растворима в воде. Является компонентом свекловичного сока, недозрелых фруктов.
Молочная кислота. Впервые получена из прокисшего молока
(Шееле, 1780 г.), откуда и возникло название. Берцелиус установил (1804 г.), что в мышечной ткани содержится вещество, аналогичное молочной кислоте. Либих выделил это вещество из мышечной ткани (1832 г.) и установил, что она по составу и многим свойствам аналогична молочной кислоте брожения. Он назвал это вещество мясомолочной кислотой. Различие между двумя кислотами состояло в том, что молочная кислота брожения не обладала оптической активностью, а мясомолочная кислота вращала плоскость поляризации вправо. Позже было установлено, что сбраживанием сахарозы в присуствии Bacillus acidi laevolactici можно получить левовращающую молочную кислоту. Таким образом, в природе молочная кислота существует в виде право- и левовращающих стереоизомеров, являющихся энантиомерами, а также оптически неактивной рацемической смеси.
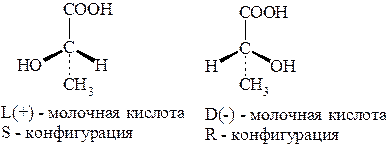
Яблочная (моногидроксиянтарная) кислота. Из названия кислоты следует, что она содержится в яблоках, откуда впервые была получена. Содержится во многих фруктах. Существует в виде пары энантиомеров, а также в виде оптически неактивного индивидуального вещества - рацемата:
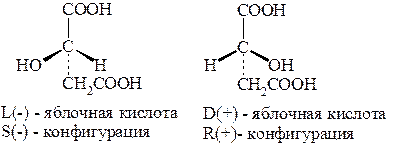
Изучая реакционную способность яблочной кислоты, П.И. Вальден (1896 г.) установил, что возможно взаимопревращение одного стереоизомера в другой. Это происходит в процессе замещенеия гидроксигруппы при асимметрическом атоме на хлор под действием PCl5: из L-яблочной кислоты образуется D-хлорянтарная кислота, которая далее под действием :ОН– переходит в D-яблочную кислоту. Такое изменение (обращение) конфигурации при асимметрическом атоме получило название вальденовского обращения, что можно представить в виде схемы:
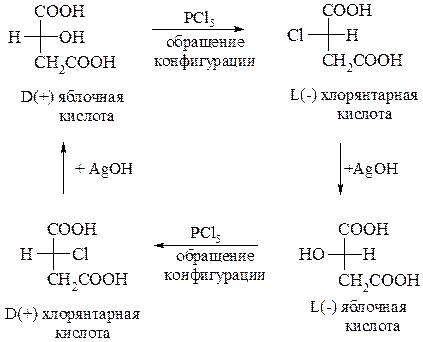
Следует обратить внимание, что обращение конфигурации при асимметрическом атоме углерода протекает по SN2 –механизму. Аналогичные вальденовскому обращению процессы могут быть осуществлены и с некоторыми другими соединениями.
Винные кислоты HOOC – CH(OH) – CH(OH) – COOH.
В молекуле дигидроксиянтарной кислоты содержатся два асимметрических углеродных атома с одинаковым набором заместителей – Н и ОН. Стереохимия винных кислот подробно рассмотрена в главе 4 (разд. 4.4). Один из изомеров был впервые выделен Шееле из осадка, образующегося при стоянии виноградного вина (винный камень). Сам винный камень представляет монокалиевую соль правовращающего изомера.
При нагревании с водой D-винная кислота постепенно переходит в оптически неактивную мезовинную кислоту и далее в виноградную кислоту, представляющую собой рацемат – (±) винную кислоту. Таким образом, известны четыре формы винных кислот D(+) винная (т. пл. 170оС; удельное вращение + 12,0); L(-) винная (т. пл. 170оС; удельное вращение – 12,0); неактивная виноградная кислота, являющаяся рацематом (т. пл. 206оС) и оптически неактивная мезовинная кислота (т. пл. 140оС). L-Винную кислоту получают путем расщепления виноградной кислоты на антиподы. В малых количествах L-винная кислота содержится в некоторых сортах виноградных вин; мезовинная в природе не обнаружена:
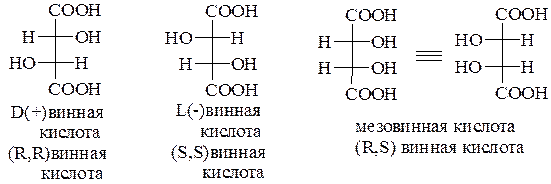
Винная кислота образует два типа солей: кислые соли – гидротартраты, средние соли – тартраты. Двойная соль – калия-натрия тартрат (сегнетова соль), будучи растворимым виц-диолом, способна реагировать с гидроксидом меди (II) в момент его образования. Благодаря этому гидроксид меди (II) не выделяется в виде осадка, а удерживается в растворе в виде комплексного соединения ярко-синего цвета.
Реактив, известный под названием реактив Фелинга(фелингова жидкость), готовится из сегнетовой соли, сульфата меди (II) и гидроксида натрия и используется в качественном и количественном анализе альдегидов и моносахаридов.
 Лимонная кислота (2-гидрокси-1,2,3-пропантрикарбоновая кислота). Содержится в ягодах, плодах цитрусовых и других фруктов, листьях хлопчатника, стеблях махорки. В соке лимонов содержание лимонной кислоты достигает 7%, а в махорке (Nicotiana rustica L) - 17%, откуда и получают ее в промышленном масштабе. Является важным промежуточным продуктом обмена веществ в цикле трикарбоновых кислот. Используется в гематологии в качестве вещества, препятствующего свертыванию крови.
Лимонная кислота (2-гидрокси-1,2,3-пропантрикарбоновая кислота). Содержится в ягодах, плодах цитрусовых и других фруктов, листьях хлопчатника, стеблях махорки. В соке лимонов содержание лимонной кислоты достигает 7%, а в махорке (Nicotiana rustica L) - 17%, откуда и получают ее в промышленном масштабе. Является важным промежуточным продуктом обмена веществ в цикле трикарбоновых кислот. Используется в гематологии в качестве вещества, препятствующего свертыванию крови.
При нагревании в кислой среде лимонная кислота отщепляет муравьиную кислоту, превращаясь в ацетондикарбоновую кислоту. Последняя декарбоксилируется, что приводит к ацетону:
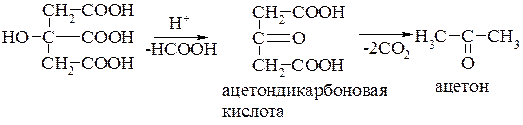
Дата добавления: 2020-10-01; просмотров: 715;











