Реакции электрофильного замещения в ароматических аминах.
В разделе (10.3.2) было показано, что такие заместители I рода, как –NH2, –NHR и –NR1R2 являются электронодонорами и, благодаря сильному + M – эффекту (+М >> I), активируют бензольное ядро, облегчая реакции электрофильного замещения в орто- и пара-положениях. По этой причине ароматические амины очень энергично вступают в реакции галогенирования, нитрования, сульфирования, формилирования, нитрозирования, которые протекают по SE – механизму. Соотношение образующихся орто- и пара-замещенных продуктов реакции зависят от характера реагента, температуры и природы заместителей в ядре ароматического амина.
Например, бромирование анилина очень легко протекает под действием бромной воды с образованием триброманилина, нерастворимого в воде белого творожистого осадка:
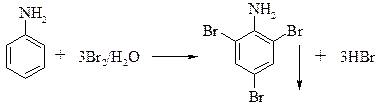
Нитрование аминов следует проводить после предварительной защиты аминогруппы во избежание окисления. Поэтому в подобных случаях осуществляют предварительное N-ацилирование, а затем используют нитрующие смеси (HNO3 + H2SO4), водный раствор азотной кислоты в уксусном ангидриде:
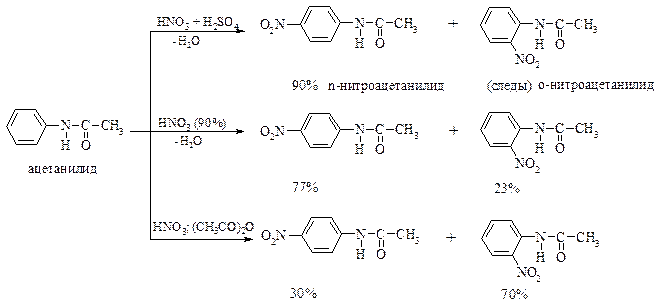
Из представленнной схемы видно соотношение орто- и пара-изомеров в зависимости от условий нитрования.
Сульфирование анилина методом «запекания» имеет важное промышленное значение для получения сульфаниловой кислоты. Вначале из эквивалентных количеств анилина и серной кислоты получают кислую соль, которую затем в сухом виде нагревают несколько часов при температуре 180 – 200оС.
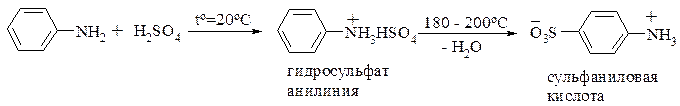
Формилирование третичных аминов с высоким выходом можно осуществлять смесью диметилформамида и оксида – хлорида фосфора (V):
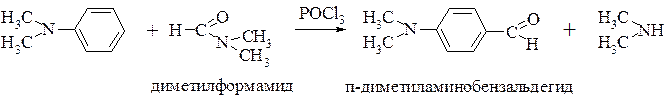
Нитрозирование – см. выше (реакции аминов с азотистой кислотой).
Дата добавления: 2020-10-01; просмотров: 681;











