Ароматические диазосоединения
 Существует два родственных класса соединений, содержащих общий структурный фрагмент , называемый азогруппой. Здесь оба атома находятся в состоянии sp2-гибридизации.
Существует два родственных класса соединений, содержащих общий структурный фрагмент , называемый азогруппой. Здесь оба атома находятся в состоянии sp2-гибридизации.
Когда каждый из двух атомов азота связан с атомом углерода органического радикала, то этот тип соединений относится к азосоединениям.
Если же с углеродным атомом органического радикала связан только один атом азота, а второй атом азота – с анионом сильной кислоты, то такие соединения относятся к диазосоединениям.
В ароматических диазосоединениях один из атомов азота диазогруппы связан с углеродом ароматического ядра, а второй атом азота – с остатком сильной минеральной кислоты.
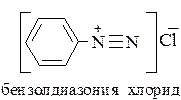
К диазосоединениям относят также вещества, образующиеся из солей арилдиазония под действием щелочей:
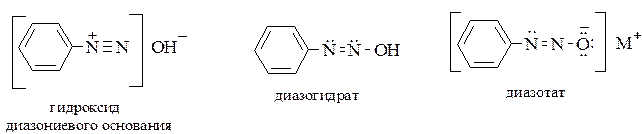
Методы синтеза
Соли арилдиазония получают действием азотистой кислоты – HNO2 на раствор первичного ароматического амина в кислой среде.
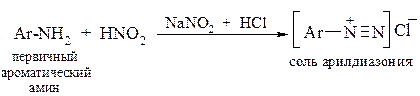
Реакция получения диазосоединения взаимодействием первичного амина с азотистой кислотой называется диазотированием.
В обычных условиях диазотирующими частицами являются молекулы протонированной азотистой кислоты или катион нитрозония:
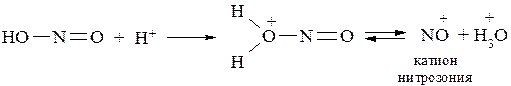
Помимо азотистой кислоты в условиях реакции диазотирования может образоваться оксид азота (III) N2O3 (азотистый ангидрид), который также является диазотирующим реагентом.
Диазотирование всегда проводится в кислой среде, где имеет место равновесная реакция, сильно смещённая вправо:
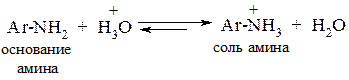
Несмотря на это в реакцию диазотирования вовлекается амин в виде основания.
Реакция протекает в несколько стадий, однако лимитирующей кинетику процесса является образование N-нитрозопроизводного, который в кислой среде переходит в свою таутомерную форму – диазогидрат. Далее диазогидрат протонируется, а затем, отщепив воду, переходит в катион диазония:
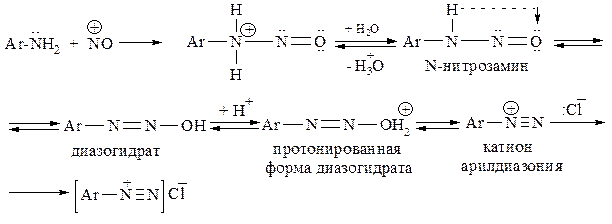
Для проведения реакции диазотирования амин растворяют в водном растворе, содержащем двух - трёхкратный избыток минеральной кислоты (чаще всего HCl или H2SO4). Избыток кислоты необходим для поддержания кислой среды (pH < 2). Температурный режим реакции диазотирования должен поддерживаться в пределах 0-5оС.
Получаемые таким путём соли диазония в большинстве случаев не выделяют из раствора, а сразу же вводят в последующие превращения.
В индивидуальном состоянии соли арилдиазония представляют собой бесцветные кристаллические соединения, растворимые в воде. Они, как правило, нестабильны. Перхлораты и нитраты взрывоопасны и взрываются от лёгкого нагревания и/или трения.
Дата добавления: 2020-10-01; просмотров: 835;











