Химические свойства аминов
Основность. Амины как производные аммиака характеризуются не только нуклеофильными, но и основными свойствами, что обусловлено наличием неподеленной электронной пары на аминном атоме азота.
Как нуклеофильность, так и основность сильно зависят от электронной плотности на атоме азота: они уменьшаются с уменьшением электронной плотности или при экранировании атома азота и увеличиваются с увеличением электронной плотности.
Электронный и пространственный факторы могут конкурировать между собой, что наглядно проявляется на примере метиламинов: в водных растворах основность уменьшается в следующей последовательности:
(CH3)2NH > CH3 – NH2 > (CH3)3N
Известно, что метильная группа характеризуется +I-эффектом, поэтому основность диметиламина выше, чем у метиламина (а метиламин более сильное основание, чем аммиак).
Казалось бы, что триметиламин в водных растворах должен проявлять более сильные основные свойства, чем метиламин и диметиламин. Однако в действительности наблюдается обратная картина, поскольку преобладающим фактором в этом случае является не электронный эффект (+I-эффект трех CH3-групп), а пространственный: атом азота сильно экранирован тремя объемными метильными группами, что затрудняет присоединение протона с последующей сольватацией третичного амина.
В газовой фазе основность аминов изменяется в такой последовательности:
(CH3)3N > (CH3)2NH > CH3NH2 > NH3
Анилин является гораздо более слабым основанием, поскольку орбиталь с неподеленной парой электронов участвует в р,π-сопряжении с ароматическим ядром:
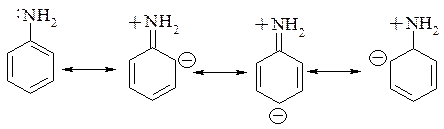
Именно за счёт резонансной стабилизации основность анилина гораздо ниже по сравнению с аммиаком и алифатическими аминами.
Будучи более сильными основаниями, чем вода, амины способны в водных растворах повышать концентрацию гидроксид-анионов:
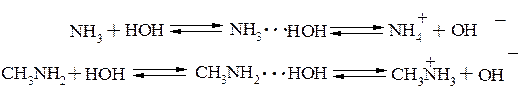
Амины как и аммиак превращаются в соли при действии минеральных кислот и легко вытесняются из солей при действии гидроксид – аниона
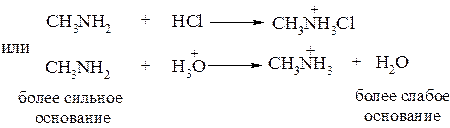
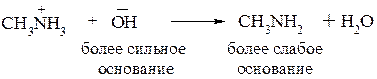
Полярность связи N–H обусловлена различной электроотрицательностью этих атомов. По этой причине атом водорода в первичных и вторичных аминах способен отщепляться в виде иона Н+, что свидетельствует об их NH–кислотности. Первичные и вторичные амины являются более слабыми кислотами, чем спирты. Данные свойства аминов проявляются лишь в присутствии сильных оснований.
При отщеплении протона от амина образуются амид-анионы:
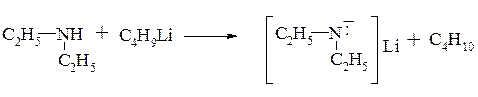
Нуклеофильные свойства аминов обусловлены также наличием неподеленной электронной пары: как активные нуклеофилы они взаимодействуют с различными электрофильными центрами, что ранее уже было рассмотрено в предыдущих главах:
алкилирование аминов (разд. 11.3.1.)
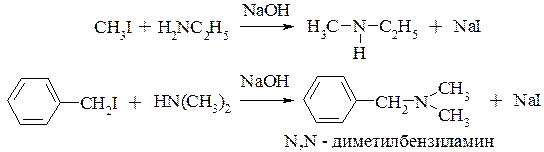
получение амидов кислот (реакции ацилирования) (разд. 17.3.2.)
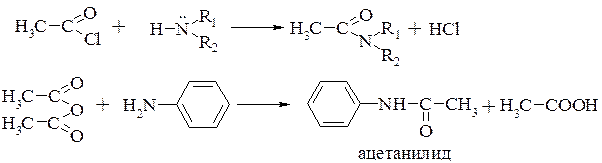
взаимодействие с альдегидами и кетонами с образованием N-замещенных иминов (разд. 16.3.1.5.)
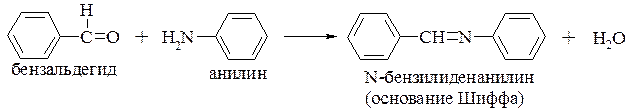
Изонитрильная реакция. Качественной реакцией на первичные амины является образование изонитрила (карбиламина). Все первичные амины взаимодействуют с хлороформом в щелочной среде:

Образующиеся изонитрилы имеют крайне неприятный запах и высоко-токсичны.
Строение изонитрила можно представить двумя предельными структурами:
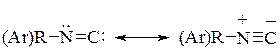
Таким образом, изонитрилы представляют собой линейные диполярные структуры с семиполярной связью.
Реакции аминов с азотистой кислотой.
Амины по-разному реагируют с азотистой кислотой HONO. Как известно, эта кислота крайне неустойчива и в свободном виде не существует. Поэтому ее получают непосредственно в реакционной среде взаимодействием нитрита натрия с минеральной кислотой, чаще всего с HCl. Обычно в реакционной среде генерируемая азотистая кислота присутствует в протонированной форме, из которой далее образуется катион нитрозония. Именно катион–нитрозония, будучи электрофильной частицей, далее участвует в реакциях с аминами:
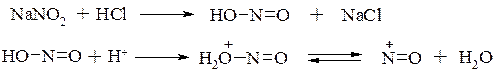
Первичные ароматические амины, взаимодействуя с азотистой кислотой, образуют соли диазония, которым посвящен раздел 19.3:
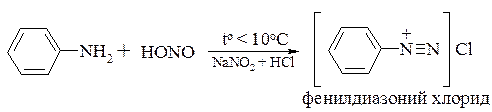
Первичные алифатические амины также образуют диазосоединения, но они, как правило, очень быстро разрушаются ввиду нестабильности:
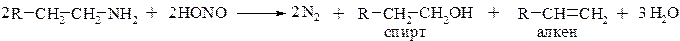
Вторичные алифатические и ароматические амины с азотистой кислотой образуют N-нитрозоамины:
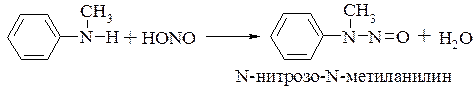
Третичные алифатические амины на холоду устойчивы к действию азотистой кислоты, но при нагревании они могут подвергаться дезалкилированию с последующим образованием N-нитрозопроизводного вторичного амина:
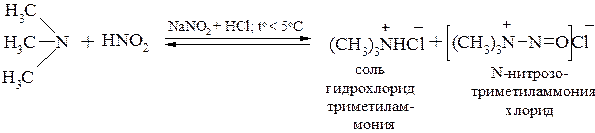
Третичные ароматические амины с азотистой кислотой вступают в реакцию электрофильного замещения с образованием преимущественно пара-нитрозосоединения. Если пара-положение занято, то образуются орто-нитрозопроизводные:
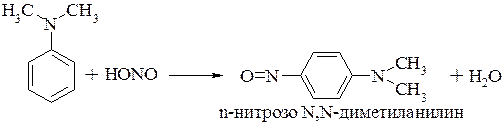
Дата добавления: 2020-10-01; просмотров: 1283;











