Отдельные представители
Муравьиная кислота (метановая кислота) – бесцветная прозрачная жидкость с резким характерным запахом. В промышленности получают из оксида углерода (II) и гидроксида натрия с последующим действием на полученную соль серной кислотой:
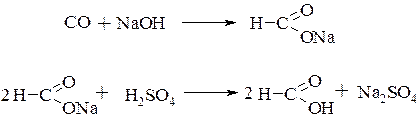
От остальных карбоновых кислот муравьиная кислота отличается тем, что карбоксильная группа в ней связана не с углеводородным радикалом, а с атомом водорода. Поэтому муравьиную кислоту можно рассматривать и как кислоту, и как альдегид:
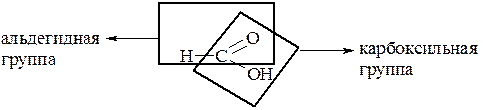
Подобно альдегидам, муравьиная кислота может окисляться:
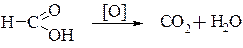
поэтому для нее характерна реакция «серебряного зеркала»:

Под действием концентрированной серной кислоты муравьиная кислота разлагается на СО и воду:
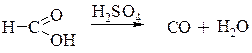
Муравьиную кислоту применяют в промышленном органическом синтезе.
Уксусная кислота (этановая кислота) – бесцветная, прозрачная жидкость, с характерным резким запахом уксуса. Безводная уксусная кислота существует в виде кристаллов, имеющих температуру плавления 16,6оС. Поэтому такую кислоту называют ледяной уксусной кислотой. С водой смешивается во всех соотношениях.
В промышленности кислоту получают различными методами:
окислением уксусного альдегида, который в свою очередь получают либо окислением этилена, либо из ацетилена по реакции Кучерова;
карбонилированием метанола;
каталитическим окислением бутана:
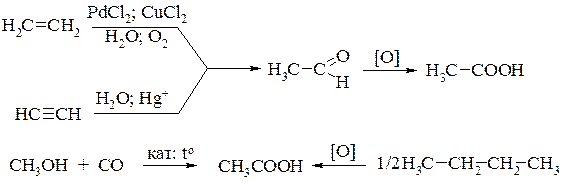
Уксусная кислота находит применение в промышленном органическом синтезе для получения уксусного ангидрида, уксусноэтилового и уксуснобутилового эфиров, красителей и лекарственных веществ, а также в кожевенном производстве и пищевой промышленности.
 Остаток уксусной кислоты называется ацетильным радикалом (от лат. acetum – уксус). Соли и эфиры уксусной кислоты называют ацетатами.
Остаток уксусной кислоты называется ацетильным радикалом (от лат. acetum – уксус). Соли и эфиры уксусной кислоты называют ацетатами.
 Валериановая– и изовалериановая кислоты –
Валериановая– и изовалериановая кислоты –
Обе кислоты являются компонентами корней с корневищами различных видов валерианы. Обладают успокаивающим действием, однако активность изовалериановой кислоты намного выше. Изовалериановая кислота используется в синтезе такого важного лекарственного препарата, как Валидол.
Введение брома в α-положение способствует усилению седативного действия. В виде этилового эфира α-бромизовалериановая кислота входит в состав комбинированных лекарственных препаратов – Корвалола, Валокордина.
Пальмитиновая C15H31COOH и стеариноваяC17H33COOH кислоты являются важнейшими представителями высших жирных кислот. Они входят в состав твердых жиров.
Олеиновая кислота C17H33COOH является ненасыщенной высшей жирной кислотой. Входит в состав жидких жиров. Содержит непредельную связь в углеводородном радикале: 
 Линолевая кислота С17H31COOH ненасыщенная кислота с двумя двойными связями:
Линолевая кислота С17H31COOH ненасыщенная кислота с двумя двойными связями:
Входит в состав льняного, конопляного и макового масел.
 Линоленовая кислота С17H29COOH сопутствует линолевой кислоте в льняном масле.
Линоленовая кислота С17H29COOH сопутствует линолевой кислоте в льняном масле.
Щавелевая кислота – HOOC–COOH. Бесцветное кристаллическое вещество, растворимое в воде. Относится к сильным кислотам. Широко распространена в растениях. В виде кальциевой соли содержится в оболочках клеток и внутри клеток растений. Оксалатом кальция богаты водоросли, грибы, лишайники, папоротники. В виде монозамещенной калиевой соли («кислая соль») содержится в щавеле и кислице.
Янтарная кислота – HOOC–CH2–CH2–COOH. Бесцветное кристаллическое вещество, растворимое в воде. Название этой кислоты связано с тем, что ее впервые открыли в янтаре. Она содержится в незрелых ягодах крыжовника, винограда, в свекольном соке. Велико биологическое значение янтарной кислоты, поскольку она участвует в цикле трикарбоновых кислот (цикле Кребса). Здесь вследствие дегидрирования из янтарной кислоты образуется фумаровая кислота. Этот процесс ферментативно стереоспецифичен и приводит к транс-фумаровой кислоте. Именно этот изомер вовлекается в дальнейшие превращения.
Энергия, получаемая в результате окислительных процессов в цикле трикарбоновых кислот, становится биохимически доступной благодаря АТФ (аденозинтрифосфорной кислоте).
Малоновая кислота представляет собой кристаллическое вещество, легко разлагающееся при нагревании: происходит декарбоксилирование и образуется уксусная кислота:
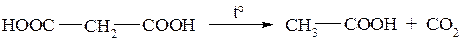
Практическое значение в органическом синтезе имеет полный этиловый эфир малоновой кислоты, который обычно называют малоновым эфиром. В малоновом эфире, благодаря влиянию двух электроноакцепторных карбонилов, метиленовая группа является СН-кислотным центром и, следовательно, атомы водорода способны отщеплятся в виде ионов за счёт гетеролитического разрыва связей С–Н. Для малонового эфира рКα равна 13.
При действии металлического натрия (или этилата натрия) один атом водорода метиленовой группы замещается на натрий с выделением водорода или этанола и образованием енолята, отрицательный заряд которого делокализован между обоими карбонильными группами. При взаимодействии образовавшегося натриймалонового эфира с первичными или вторичными алкилгалогенидами натрий замещается на алкильный радикал и образуется алкилмалоновый эфир. Далее это производное можно подвергнуть кислотному гидролизу, затем провести декарбоксилирование и получить соответствующую карбоновую кислоту.
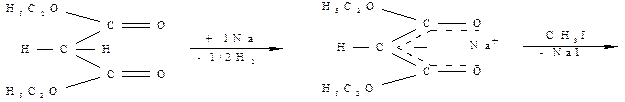
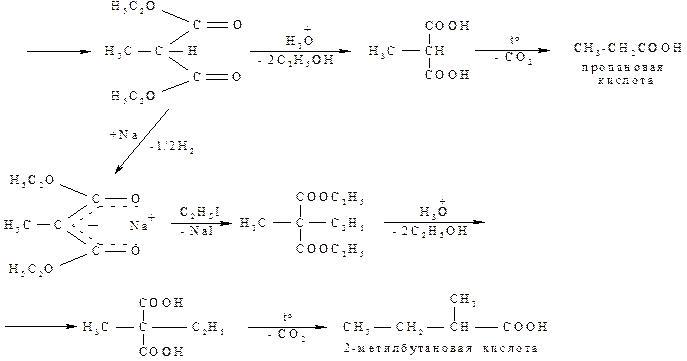
Возможен и другой путь, когда полученный алкилмалоновый эфир вновь взаимодействует последовательно с натрием, затем алкилгалогенидом с последующим гидролизом и декарбоксилированием:
Диэтилмалоновый эфир, получемый таким же путем, используется в синтезе барбитала (см. раздел 25.6).
Дата добавления: 2020-10-01; просмотров: 652;











