Функциональные производные карбоновых кислот
Соединения, получаемые путем замещения OH–группы карбоксила кислоты на нуклеофильные заместители, называются функциональными производными карбоновых кислот. Они соответствуют общей структурной формуле (I), где Z представляет собой атом или группу атомов:
 OAlk (OCH3; OC2H5 и т.п.) или – OАr – сложные эфиры;
OAlk (OCH3; OC2H5 и т.п.) или – OАr – сложные эфиры;
 Сl, Br (галогены) – галогенангидриды;
Сl, Br (галогены) – галогенангидриды;
ангидриды;
NH2 (-NHR1; -NR1R2) амиды.
О принадлежности анализируемого вещества к функциональным производным карбоновых кислот легко убедиться по реакции гидролиза: если в итоге образуется карбоновая кислота, то соединение является функциональным производным карбоновой кислоты.
Способы получения сложных эфиров, галогенангидридов, ангидридов и амидов рассмотрены выше (раздел 17.3). Ниже будут показаны наиболее важные свойства с точки зрения их реакционной способности.
Сложные эфиры
По распространенности, доступности, а также широкому использованию в органическом синтезе сложные эфиры являются несомненными лидерами среди остальных функциональных производных карбоновых кислот.
Физические свойства. Сложные эфиры, образованные низшими представителями кислот и спиртов, представляют собой жидкости. Они обладают приятным запахом, напоминающим фруктовый. В воде сложные эфиры растворяются очень мало, или вовсе не растворяются. Температуры кипения сложных эфиров значительно ниже, чем у соответствующих карбоновых кислот. Это объясняется отсутствием межмолекулярных водородных связей.
Химические свойства. Существенное отличие сложных эфиров от карбоновых кислот заключаются в том, что в них отсутствует подвижный протон, а вместо него с атомом кислорода связан углеводородный радикал. По этой причине в кислотном остатке имеется только один электрофильный центр – атом углерода в остатке карбоксильной группы.
Полярность связей в сложном эфире примерно такая же как в карбоновых кислотах.
Для сложных эфиров характерны реакции нуклеофильного замещения, в результате которых могут образовываться либо кислота, либо другие функциональные производные этой же кислоты. Одной из таких реакций является взаимодействие с водой, т.е. гидролиз, который может катализироваться как кислотой, так и основанием.
Гидролиз в кислой среде по существу представляет собой обратную реакцию синтеза сложных эфиров в присутствии кислоты. Наиболее часто кислотный гидролиз происходит благодаря расщеплению связи ацил – кислород (АС- ацйльный механизм):
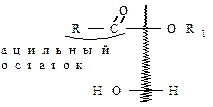
Кислотный катализ обозначается символом А и протекает по бимолекулярному механизму AAC2:
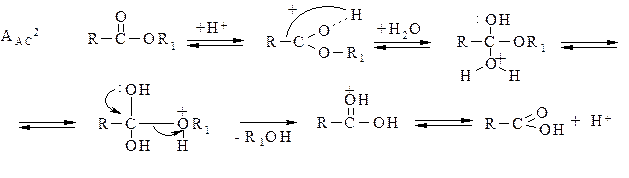
Щелочной гидролиз обозначается символом В и относится к типу ВАС2 (бимолекулярный ацильный механизм). В отличие от кислотного гидролиза щелочной необратим, поскольку приводит к образованию солей, которые устойчивы к действию нуклеофилов:
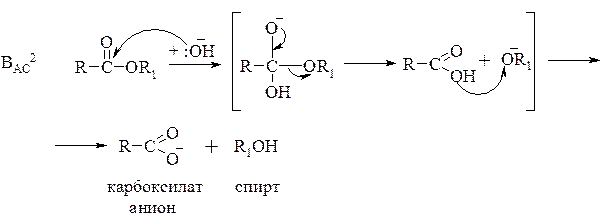
Переэтерификация. В кислотно-катализируемом гидролизе сложных эфиров основной стадией является присоединение воды (см. выше реакцию ААС2). Вода, как известно, является нуклеофилом. Если вместо воды использовать спирт, то происходит замена одного нуклеофила – воды на другой нуклеофил – спирт. Поэтому вместо гидролиза происходит переэтерификация, т.е. один сложный эфир превращается в другой сложный эфир той же кислоты:
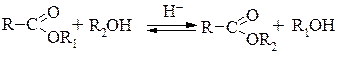
Переэтерификация относится к обратимым процессом и для смещения равновесия вправо используют избыток спирта - R2OH.
Взаимодействие сложных эфиров с нуклеофилами типа NH2X:
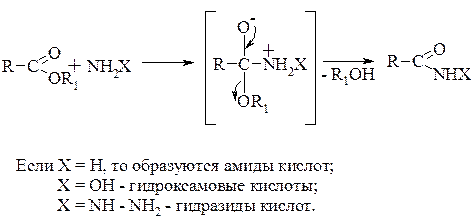
Сложноэфирная конденсация. Сложные эфиры карбоновых кислот, имеющих α-водородный атом (СН – кислотный центр при атоме углерода в α-положении), в присутствии сильных оснований, например, алкоголятов щелочных металлов, способны к образованию карбанионов. Далее к этому карбаниону присоединяется вторая молекула этого же сложного эфира с образованием β-кетокарбоновой кислоты:
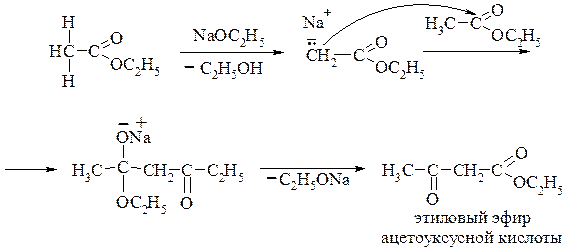
Восстановление. Сложные эфиры в присутствии такого сильного восстановителя, как алюмогидрид лития, легко восстанавливаются до первичных спиртов:
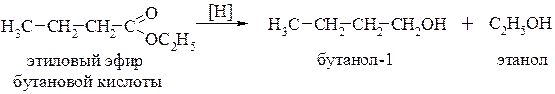
Получение третичных спиртов. Сложные эфиры взаимодействуют с реактивом Гриньяра с образованием промежуточного продукта, после гидролиза которого образуются соответствующие третичные спирты. Обычно в этой реакции участвует 2 моля магнийорганического соединения:
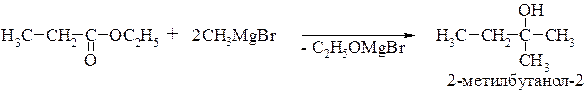
Дата добавления: 2020-10-01; просмотров: 702;











