Эффект Джоуля-Томсона.
1. Внутренняя энергия реального газа. Вследствие хаотичного движения молекулы реального газа обладают такой же кинетической энергией, как и молекулы идеального газа. Величина этой кинетической энергии 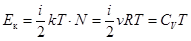 . Но в отличие от идеального газа молекулы реального газа еще взаимно притягиваются, чем обусловлена их потенциальная энергия Ек. Изменение потенциальной энергии газа в случае его изотермического расширения равно работе, которую должны совершить внешние тела по преодолению сил внутреннего давления.
. Но в отличие от идеального газа молекулы реального газа еще взаимно притягиваются, чем обусловлена их потенциальная энергия Ек. Изменение потенциальной энергии газа в случае его изотермического расширения равно работе, которую должны совершить внешние тела по преодолению сил внутреннего давления. 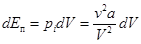 . (15.1)
. (15.1)
Потенциальная энергии реального газа 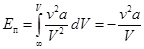 . (15.2)
. (15.2)
 Итак, внутренняя энергия реального газа равна
Итак, внутренняя энергия реального газа равна 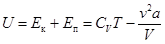 . (15.3)
. (15.3)
2. Опыт Джоуля-Томсона состоит в пропускании газа через пористую перегородку в теплоизолированной трубе с большим перепадом давления. Он был реализован в совместных экспериментах Дж.Джоуля и У.Томсона в 1852 – 62 г.
В теплоизолированной трубе слева направо (по рис.48) двигаются поршни S1 и S2. Газ из левой части трубы под давлением р1 продавливается (дросселирует) через пористую перегородку А в правую часть, в которой давление р2 << р1. Давления р1 и р2 постоянны. Чтобы сохранять перепад давления р1 - р2 большим, стенка S2 должна двигаться быстрее стенки S1.
Оказалось, что в одних случаях температура газа понижалась, в других – повышалась. Это изменение температуры называют эффектом Джоуля – Томсона.
3. Теория опыта Джоуля – Томсона. Определим величину и знак изменения температуры газа DT = T2 - T1. Пусть 1 моль газа занимал перед дросселированием объем V1 в левой части трубы под давлением p1, а после дросселирования – объем V2 под давлением p2в правой части. Причем р1 >> р2, а V2 >> V1. Работа по перемещению левого поршня S1 совершается внешними телами и равна A1 =p1V1. Работа по перемещению правого поршня S2 совершается газом над внешними телами и равна A2 =p2V2.
Работа, совершаемая внешними телами над газом, в целом есть A1 - A2 = p1V1 - p2V2. Эта работа идет на увеличение внутренней энергии газа.
A1 - A2 = U2 - U1 или A1 + U1 = A2 + U2, или U1 + p1V1 = U2 + p2V2 . (15.4)
Подставим сюда выражение (15.3) для внутренней энергии реального газа и давление p из уравнения Ван-дер-Ваальса по формуле (14.2).
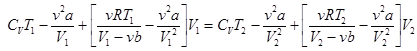 . (15.5)
. (15.5)
Равенство упрощается, если учесть, что в правой части объем V2 велик, и поэтому членами 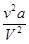 и vb можно пренебречь:
и vb можно пренебречь: 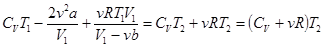 . (15.6)
. (15.6)
Преобразуем 3-й член: 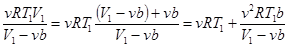 и подставляем. (15.7)
и подставляем. (15.7)
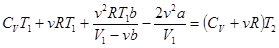 , или
, или 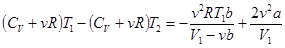 . Отсюда
. Отсюда 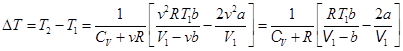 . (15.8)
. (15.8)
 4. Температура инверсии. Знак изменения температуры зависит от соотношения членов в скобках. Могут быть ситуации, когда DT = 0. В этом случае
4. Температура инверсии. Знак изменения температуры зависит от соотношения членов в скобках. Могут быть ситуации, когда DT = 0. В этом случае 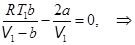
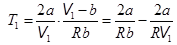 . (15.9)
. (15.9)
Температура Т1, при которой эффект Джоуля – Томсона не наблюдается (DT = 0), зависит от величины начального мольного объема газа V1, который формально не может быть меньше поправки b. С ростом начального объема V 1 температура Т1 нулевого эффекта стремится к пределу 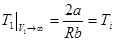 , (15.10)
, (15.10)
 который называется температурой инверсии.
который называется температурой инверсии.
Если температура газа при дросселировании понижается, DT < 0, говорят эффект положителен. Если газ при дросселировании нагревается, DT > 0, говорят, эффект отрицателен.
 Точки кривой на графике (рис.49) соответствуют температуре Т1, при переходе через которую при данном начальном объеме V1 знак эффекта Джоуля – Томсона меняется. Если Т1 > Тi = 2a| Rb, то знак эффекта уже не зависит от начального объема, DT > 0, эффект только отрицателен. Величина температурного перепада DT изменяется с величиной начальных параметров Т1 и V 1 (рис.50).
Точки кривой на графике (рис.49) соответствуют температуре Т1, при переходе через которую при данном начальном объеме V1 знак эффекта Джоуля – Томсона меняется. Если Т1 > Тi = 2a| Rb, то знак эффекта уже не зависит от начального объема, DT > 0, эффект только отрицателен. Величина температурного перепада DT изменяется с величиной начальных параметров Т1 и V 1 (рис.50).
Чтобы найти оптимальный объем V 1опт, при котором положительный эффект максимален, надо исследовать DT на экстремум по V1: 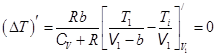 . (15.11)
. (15.11)
Отсюда,
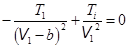 , или
, или 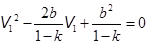 . (15.12)
. (15.12)
Здесь k = T1| Ti . Так как DT < 0, то k < 1. Из уравнения (15.1) находится оптимальный начальный объем.
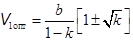 . (15.13)
. (15.13)
Так как минус в скобках приводит к V 1 < b, то остается один корень.
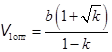 . (15.14)
. (15.14)
 5. Характеристические температуры реальных газов. Это температуры критическая Тк, Бойля ТБ и инверсии Тi (таблица 10).
5. Характеристические температуры реальных газов. Это температуры критическая Тк, Бойля ТБ и инверсии Тi (таблица 10).
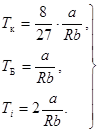
Все температуры однозначно определяются поправками Ван-дер-Ваальса a и b.
Знание этих температур позволяет прогнозировать степень отклонения реальных газов от идеальных при разных температурах и выбирать оптимальные условия для сжижения газов.
Изменение температуры газа при его адиабатном дросселировании объясняется тем, что при расширении газа увеличивается расстояние между молекулами, а, следовательно, совершается работа против сил взаимодействия между ними. Эта работа совершается за счет кинетической энергии молекул (расширение адиабатное), что и приводит к изменению температуры газа.
6. Сжижение газов. Технология сжижения сводится к охлаждению газа до температур ниже критической и сжатию газа при этих температурах.
а. Метод Линде, 1895. Поскольку за один цикл адиабатного дросселирования не удается понизить температуру газа до критической, немецкий инженер Линде предложил дросселировать газ многократно, понижая постепенно его температуру в теплообменнике на (рис.51).
 Компрессор К всасывает газ при комнатной температуре Т0 и давлении р0 = 1 атм и сжимает его до давления р1 = 200 атм. Газ при этом нагревается. Пройдя водяной холодильник Хк, он вновь остывает до температуры Т0. Пройдя дроссель Др, после которого давление падает с 200 до 1 атм, газ охлаждается до Т2 < T1 и попадает в резервуар Рр. Но после первого прохода газ еще не охладился до температуры ниже критической. Поэтому он возвращается в компрессор К через теплообменник Тк , где охлаждает вторую порцию газа до Т < T0. После многократного прохождения газа через теплообменник его температура понижается постепенно ниже критической, после чего при дросселировании газ частично конденсируется и накапливается в резервуаре Рp. Через кран Кр конденсат периодически сливается в сосуды Дьюара.
Компрессор К всасывает газ при комнатной температуре Т0 и давлении р0 = 1 атм и сжимает его до давления р1 = 200 атм. Газ при этом нагревается. Пройдя водяной холодильник Хк, он вновь остывает до температуры Т0. Пройдя дроссель Др, после которого давление падает с 200 до 1 атм, газ охлаждается до Т2 < T1 и попадает в резервуар Рр. Но после первого прохода газ еще не охладился до температуры ниже критической. Поэтому он возвращается в компрессор К через теплообменник Тк , где охлаждает вторую порцию газа до Т < T0. После многократного прохождения газа через теплообменник его температура понижается постепенно ниже критической, после чего при дросселировании газ частично конденсируется и накапливается в резервуаре Рp. Через кран Кр конденсат периодически сливается в сосуды Дьюара.
Метод Линде прост, в машине нет движущихся частей (за исключением компрессора) и поэтому нет проблемы смазки. Но он малоэффективен.
б. Метод Клода, 1902 г. Французский инженер Клод заменил дроссель цилиндром с поршнем. Благодаря этому расширение газа сопровождается совершением им работы по перемещению поршня. Температура газа падает быстрее. Поэтому машина Клода экономичнее.
ГЛАВА 4. ЖИДКОСТИ
Дата добавления: 2020-05-20; просмотров: 656;











