Первое начало термодинамики
Первое начало термодинамики
Основные понятия и определения
Химическая термодинамика рассматривает превращения энергии при химических процессах. Главной ее задачей является установление свойств химической системы при равновесии. В основе химической термодинамики лежат первое и второе начала термодинамики.
Приступая к изучению законов химической термодинамики, необходимо усвоить основные понятия и определения.
Термодинамическая система – тело или группа тел, выделяемых из материального мира реальной или воображаемой границей.
Изолированная система – система, которая не может обмениваться с окружающей средой энергией и веществом.
Замкнутая (закрытая) – система, которая может обмениваться с окружающей средой энергией в виде теплоты (но не в виде работы), а веществом не обменивается.
Открытая система – может обмениваться энергией и веществом с другими системами.
Свойства системы – величины, характеризующие состояние системы (функции состояния). Изменение свойства не зависит от пути перехода системы из начального состояния в конечное. Справедливо и обратное утверждение: если при переходе системы из одного состояния в другое какая–то величина не зависит от пути перехода, а определяется только начальным и конечным состоянием системы, то эта величина – изменение свойства системы. Бесконечно малое изменение свойства – это полный дифференциал и обозначается знаком d. Свойства системы можно разбить на два класса.
1 Экстенсивные свойства – те, которые следуют закону аддитивности (сложения), согласно которому свойство всей системы равно сумме свойств отдельных ее частей. Такими величинами являются объем, площадь, длина, общая теплоемкость и др.
2 Интенсивные свойства – не следуют закону аддитивности. К таким величинам относятся температура, плотность, концентрация, давление, все молярные и удельные величины.
Интенсивные свойства имеют тенденцию к выравниванию.
Энергия (экстенсивное свойство) передается от одной системы к другой двумя способами: в виде теплоты или в виде работы. Теплота и работа существуют только в процессе передачи энергии, они являются функциями процесса и не существуют, когда процесс закончился.
Теплота – хаотический способ передачи энергии, а работа – упорядоченный способ. Совершать работу – это значит преодолевать сопротивление. Оба способа зависят от пути перехода.
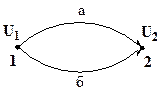
Так, при переходе системы из состояния 1 в состояние 2 изменение внутренней энергии по пути «а» и «б» одинаково.
ΔUа = ΔUб = U2 – U1.
В то же время Qa ≠ Qб и Wa ≠ Wб.
Бесконечно малое количество теплоты и работы не являются полным дифференциалом (поскольку не являются изменением) и обозначаются δQ и δW.
Процесс, связанный с выделением тепла (экзотермический), понижает запас энергии системы, т.е. U2 < U1 и Н2 < Н1 и тепловые эффекты отрицательны:
Qv = ΔU = U2 - U1 < 0
Qp = ΔH = H2 – H1 < 0
При поглощении тепла (эндотермический процесс) повышается уровень энергии и тепловые эффекты положительны:
Qv = ΔU > 0
Qp = ΔH > 0
Работа, совершаемая системой над внешними силами, положительна W > 0. Если же работа проделывается над системой, то W < 0. Так, при сжатии газа поршнем с грузом в цилиндре W < 0, а при поднятии поршня с грузом сжатым газом W > 0. Работа, теплота, внутренняя энергия, энтальпия измеряются в джоулях (Дж).
Первое начало термодинамики
Первое начало термодинамики – частный случай закона сохранения и превращения энергии в применении к процессам, сопровождающимся выделением, поглощением или преобразованием теплоты. Первое начало термодинамики можно сформулировать так:
«Тепло, подводимое к системе, расходуется на изменение внутренней энергии и совершение системой работы против внешних сил».
Q = ΔU + W (1.1)
Для бесконечно малого изменения состояния системы математическое выражение первого закона термодинамики примет вид:
δQ = dU + δW (1.2)
где dU – изменение внутренней энергии системы.
δW = PdV + δWx – сумма работы по преодолению внешнего давления PdV и, так называемой, полезной работы δWx.
В изолированной системе Q = 0 и W = 0, следовательно, ΔU = 0, а U = const.
Формулировка первого начала термодинамики для изолированной системы:
«Запас внутренней энергии в изолированной системе постоянен».
Теплоемкость
При сообщении системе теплоты δQ ее температура изменяется на dT. Величина 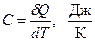 называется теплоемкостью.
называется теплоемкостью.
Теплоемкость - это количество теплоты, затрачиваемое для повышения температуры тела на один кельвин.
Теплоемкость, отнесенная к массе тела, называется удельной, С 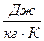 . Теплоемкость одного моля вещества, называется молярной, С
. Теплоемкость одного моля вещества, называется молярной, С 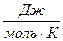 . Теплоемкость зависит от условий, в которых телу сообщается теплота и измеряется его температура. Теплоемкость при постоянном объеме равна
. Теплоемкость зависит от условий, в которых телу сообщается теплота и измеряется его температура. Теплоемкость при постоянном объеме равна 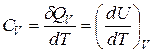 , а при постоянном давлении
, а при постоянном давлении 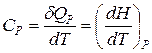 .
.
Теплоемкость газов
Внутренняя энергия системы складывается из энергии поступательного, вращательного движения и энергии колебаний (кинетической и потенциальной) частиц:
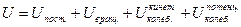
На одну степень свободы приходится энергия равная 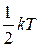 (для одной молекулы) или
(для одной молекулы) или 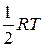 (для одного моля), поскольку
(для одного моля), поскольку 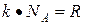
Если молекула имеет i степеней свободы, то 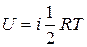 , а
, а 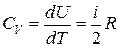 .
.
По уравнению Майера 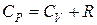 (1.3)
(1.3)
Для одноатомных идеальных газов имеются лишь три степени свободы поступательного движения в координатах x, y, z:
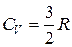 ;
; 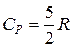 .
.
Для двухатомных идеальных газов и линейных многоатомных добавляется еще 2 степени свободы вращательного движения и, если молекула нежесткая, 2 степени свободы колебательного движения:
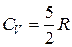 ;
; 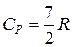 - для жестких молекул (без учета колебаний).
- для жестких молекул (без учета колебаний).
Для многоатомных жестких добавляется третья степень свободы вращательного движения:
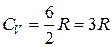 ;
; 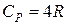
Несмотря на простоту, эти соотношения дают хорошее совпадение с экспериментом для одноатомных и многих двухатомных молекул при комнатной температуре. Но для многоатомных и ряда двухатомных молекул совпадений нет из-за неучтенного влияния на теплоемкость колебаний атомов в молекуле. Для реальных газов поступательная и вращательная составляющие могут быть вычислены с достаточной точностью из уравнений приведенных выше, а для вычисления колебательной части теплоемкости требуется применение квантовой теории.
Эксперимент показал также зависимость теплоемкости от температуры, что находится в противоречии с формулами. Эмпирическую зависимость теплоемкости газов от температуры получают в виде интерполяционного уравнения:
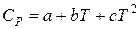 или
или 
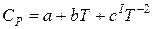 (1.4)
(1.4)
Для органических и неорганических веществ соответственно.
где а, в, с, сl – константы, применяемые в определенном интервале температур (берутся из справочника).
Дата добавления: 2016-06-22; просмотров: 2397;











