Типы тепловых эффектов
Для термохимических расчетов необходимо, чтобы все тепловые эффекты были отнесены к реагентам и продуктам в стандартном состоянии. Стандартное состояние вещества - это наиболее термодинамически устойчивая форма при давлении 1 атм, температуре 298,15 К.
Стандартная теплота образованияDH°f - тепловой эффект образования 1 моля любого вещества из простых веществ при стандартных условиях.
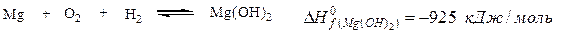
В связи с этим, теплоты образования простых веществ равны нулю, поскольку они отвечают реакциям
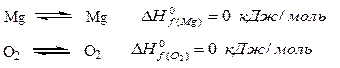
Однако, теплоты реакций
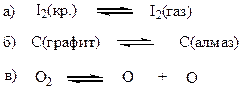
не равны нулю, так как являются теплотами процессов: агрегатного превращения (а), полиморфного превращения (б), диссоциации (в).
Стандартной теплотой образования иона в водном растворе называется теплота образования одного моля гидратированного иона в растворе с молярной концентрацией иона, равной единице, из простых веществ при стандартных условиях. При этом теплота образования иона водорода условно принята равной нулю.
С(графит) + 3/2О2 (газ) + аq + 2е → СО32-·аq, ΔНf (CO32-aq)
Стандартная теплота сгоранияDН°сгор. - это теплота сгорания 1 моля органического соединения при стандартных условиях до СO2, Н2O, SO2, N2. Если продукты сгорания, кроме СO2 и Н2O, есть и другие, это оговаривается в каждой реакции особо. Пример:
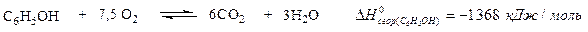
Теплоты сгорания водорода и углерода совпадают с теплотами образования Н2О и СО2, так как это тепловые эффекты реакций
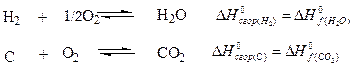
Стандартная теплота фазовых превращений- это теплота превращения 1 моля вещества при температуре перехода при Р = 1 атм. Сюда относятся теплоты плавления, испарения, возгонки (сублимации), полиморфных превращений.
Интегральной теплотой растворенияDНm называют тепловой эффект растворения с образованием раствора определенной концентрации при расчете на 1 моль растворенного вещества.
Теплота растворения газов обычно близка к теплоте их конденсации, а твердых веществ с атомной или молекулярной кристаллической решеткой - к теплоте плавления.
Более сложные процессы происходят при растворении электролитов. Теплоты растворения электролитов являются алгебраической суммой двух основных тепловых эффектов: поглощения теплоты при разрушении кристаллической решетки с удалением образовавшихся ионов на расстояния, отвечающие объему раствора, и выделения теплоты при сольватации (гидратации) каждого иона молекулами растворителя. Оба эффекта достигают сотен килоджоулей на моль. Алгебраическая сумма их - наблюдаемая теплота растворения - имеет порядок единиц и десятков килоджоулей. Знак суммарного эффекта зависит от того, какое из слагаемых больше по абсолютной величине.
Теплота гидратообразования- это теплота, выделяющаяся при присоединении к одному молю безводной соли кристаллизационной воды. Ее определяют из интегральных теплот растворения безводной соли и кристаллогидрата в таких количествах воды, чтобы полученный раствор имел бы одинаковую концентрацию. Например, получить водный раствор MgCl2 можно двумя путями:
1 - растворением безводной соли MgCl2
2 - растворением в воде кристаллогидрата MgCl2•6H20, предварительно полученного из MgCl2 и воды.
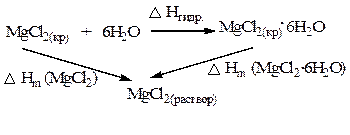
Из данной схемы по закону Гесса можно получить теплоту гидратообразования:
DН гидр = DHm(MgCl2) - DHm (MgCl2 .6H20)
Теплота нейтрализации. Опыт показывает, что в случае разбавленных растворов теплота реакции нейтрализации молярной массы эквивалента сильной кислоты (НС1, H2S04 и др.) сильным основанием (NaOH, КОН) не зависит от природы кислоты или основания. Это объясняется тем, что протекает только одна химическая реакция
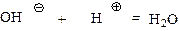
DHнейтр. = -55,9 кДж/моль
Принейтрализации разбавленного раствора слабойкислоты или основания наблюдаемая теплота нейтрализации может быть меньше или больше за счет теплоты диссоциации. Теплота диссоциации складывается из теплоты, поглощаемой при распаде молекулы на ионы и теплоты гидратации (сольватации) ионов молекулами растворителя и потому может быть как положительной, так и отрицательной. Таким образом, теплота нейтрализации слабых кислот и оснований равна
DНнейтр. = - 55,9 + DНдисс.
Закон Гесса
Г.И. Гесс в 1836 г. еще до того, как было сформулировано l начало термодинамики (1842), экспериментально открыл основной закон термохимии:
«Тепловой эффект реакции не зависит от промежуточных стадий, а определяется лишь начальным и конечным состоянием системы.»
При этом процесс должен протекать термодинамически необратимо, а получаемые продукты иметь ту же температуру, что и исходные вещества.
Этот закон может быть более строго получен на основании первого начала термодинамики. Пусть единственным видом работы является работа преодоления внешнего давления (отсутствует работа против магнитных, электрических и прочих сил). Тогда уравнение (1.2) примет вид:
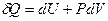
1) При изохорном процессе V = const, dV = 0.
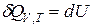
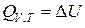
2) При изобарном процессе Р = const
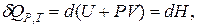
где 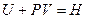
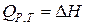
Так как теплота процесса в общем случае зависит от пути процесса, а ΔU и ΔH не зависят (поскольку и внутренняя энергия и энтальпия являются функциями состояния), следовательно теплоты процесса в частных случаях при V = const или при Р = const также не зависят от пути процесса. Таким образом, термодинамически более строгой формулировкой закона Гесса будет являться следующая:
«Максимальная теплота реакции, проведенной в изобарных либо в изохорных условиях, когда единственной работой является работа против сил внешнего давления, не зависит от промежуточных реакций, а лишь от начальных и конечных веществ и их состояний».
Дата добавления: 2016-06-22; просмотров: 4745;











