Решение задачи. Какое количество теплоты необходимо для того, чтобы 2 кг воды, взятых при 25 °С, испарить при Р = 1 атм?
Решая задачу, следует записать кроме полного условия и краткое, где четко обозначить, к какому компоненту относится данная величина, к какому состоянию, в каких единицах выражена величина, при необходимости перевести в систему СИ. При использовании справочных данных внимательно смотреть на название столбца или строки таблицы. Например, название столбца «b•103 », а число в этом столбце равно 3,45, то есть b•103 = 3,45, отсюда b = 3,45•10-3.
Задача 1. Какое количество теплоты необходимо для того, чтобы 2 кг воды, взятых при 25 °С, испарить при Р = 1 атм?
Дано:
m (H20) = 2,0 кг
t1 = 25 °C; Т1 = 298 К
t2=127 °C;T2 = 400 K
DН исп(Н20) = 40,59 кДж/моль = 40,59 .103 Дж/моль
Р = 1 атм
Q = ?
Решение
Процесс состоит из двух стадий:
1 - нагревание воды от 298 К до температуры кипения при 1 атм, т.е. до 373 К;
2 - испарение воды при 373 К и 1 атм.
Поскольку теплота испарения и теплоемкость в справочнике -молярные, следует рассчитать количество взятой воды в молях:
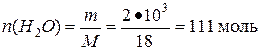
Q = n 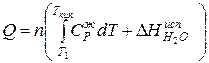
Из справочника находим коэффициенты интерполяционного уравнения
CP = a + вT + cT2 и подставляем в уравнение для Q
| a | b•103 | c•106 | |
Н2О  |
39,2 | 76,64 | 11,96 |
а = 39,2 b = 76,63•10-3 с = 11,96•10-6
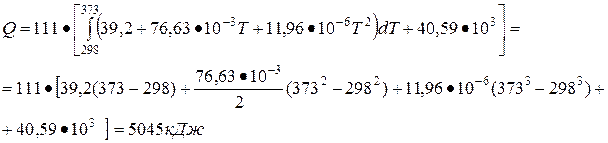
Задача 2
При 298 К 100 г кислорода сжимается адиабатически от 8,2 л до 5,1 л. Определить конечную температуру, работу сжатия, изменение энтальпии.
Дано:
m(O2) = 100 г
Т1 = 298 К
V1 = 8,2 л = 8,2.10-3 м3
V2 = 5,l л = 5,1.10 -3м3
T2 = ? DH = ? W = ?
Решение
Из таблицы выбираем уравнение для расчета работы для адиабатического процесса, исходя из данных в условии задачи. Подходящим уравнением будет следующее:


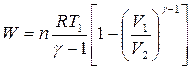
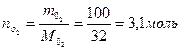

W = -4,0103 Дж
Конечную температуру находим, используя уравнение состояния
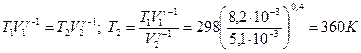
Изменение энтальпии не зависит от изменения давления или объема, а определяется лишь изменением температуры.
Примем Ср = const = 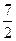 R = 3,5·8,31 =29,1 Дж/моль
R = 3,5·8,31 =29,1 Дж/моль
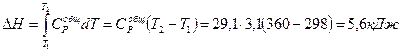
Задача 3
Вычислить тепловой эффект реакции
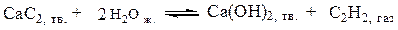
при 700 К : а) при постоянном давлении; б) при постоянном объеме/
Решение 
Тепловой эффект реакции находим, используя уравнение Кирхгофа. Будем решать двумя способами:
1. Без учета зависимости теплоемкости от температуры, т. е. DСР = const = DC0p 298
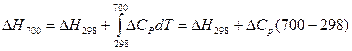
ΔН298 найдем из теплот образования, взятых в справочнике.
DН298 =S ni D  - S niD
- S niD  =
= 
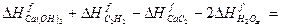
= -985,12 + 226,75 – (-59,83) – 2(-285,83) = 126,9 кДж = 126·103 Дж
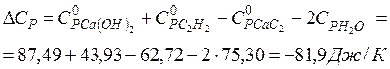
DН700= 126,9·103 – 81,9(700 - 298) = 93,1·103 Дж
Теплота при постоянном давлении и при постоянном объеме связаны соотношением:
QP = QV + Wрасш.
DН = DU + Wрасш.
DU = DН - Wрасш. = DН - Dn RT
Dn рассчитываем из реакции, учитывая только газообразные вещества,
Dn = n2 - n1 = 1 - 0 = 1
DU = 93,1·103 – 8,31·700 = 87,2·103 Дж
2.С учетом зависимости теплоемкости от температуры.
Составим таблицу по справочным данным для конечных веществ и для начальных с учетом стехиометрических коэффициентов.
| Вещество | 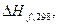 Дж/моль Дж/моль |
Коэффициенты уравнения Ср =f (T) | ||||
| а | b•103 | сl•10-5 | c•106 | |||
| Конечные вещества | Cа(ОН)2 | - 985,12 | 105,19 | 12,01 | -19,00 | - |
| С2Н2 | +226,75 | 26,4 | 66,65 | - | - 26,48 | |
| Исходные вещества | СаС2 | - 59,83 | 68,62 | 11,88 | - 8,66 | - |
| 2·Н2О | -2·285,83 | 2·39,02 | 2·76,64 | - | 2·11,96 | |
| ΔНреак.=126,88 кДж = 126,9·103 Дж | Δа = -15,03 | Δb = - 6,5•10-3 | ΔсI= -10,34•105 | Δс = 50,4•10-6 |
Полученные величины подставляем в уравнение 1.7.
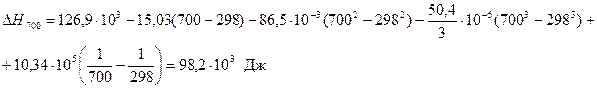
Дата добавления: 2016-06-22; просмотров: 6036;











