Способы определения тепловых эффектов при постоянной температуре
Все способы определения тепловых эффектов реакции основаны на законе Гесса. Применение закона Гесса основано на том, что с термохимическими уравнениями можно оперировать так же, как с алгебраическими.
Термохимические уравнения – уравнения реакций, для которых указываются числовые значения тепловых эффектов.
Они могут быть записаны двумя способами:
N2 + 3H2 = 2 NH3 – 91,88 Дж или
N2 + 3H2 = 2 NH3, ΔН = – 91,88 Дж
Наиболее распространенными способами определения тепловых эффектов являются следующие:
1. Непосредственно из закона Гесса
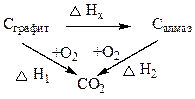
Можно выделить два пути перехода из графита в С02:
- сгоранием Cграфита,:
- через образование Cалмаза и далее сгорания Салмаза. Теплоты для разных путей равны
DН1 = DНх + DН2
DНх = DН1 - DН2
2. Из теплот образования
DНреак. = S ni DН0f (кон) - S ni DН0f(нач) 
3. Из теплот сгорания
DНреак. = S ni DН0сг(нач) - S ni DН0сг(кон) 
4. Комбинированием.
Рассмотрим применение этого метода на примере.
 Найти теплоту реакции
Найти теплоту реакции
если известны тепловые эффекты реакций:
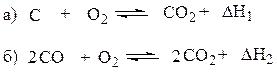
|
|
Реакции (а) и (б) следует переписать так, чтобы вещества в них находились в той части уравнения, в которой они присутствуют в искомом уравнении. То есть, если в искомом уравнении в левой части находятся С и О2, а в правой СО, то и в уравнениях (а) и (б) они должны находиться там же. Уравнение (а) этому соответствует, его не изменяем, а уравнение (б) переписываем, меняя местами компоненты:
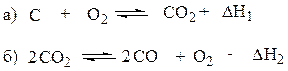
Сложением этих уравнений мы пытаемся получить искомое уравнение. Но в уравнении (б) в правой части 2СО, а в искомом СО, значит все (б) уравнение надо умножить на 1/2, получим уравнение б':
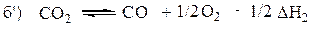
Складываем теперь уравнения (а) и (б'), взаимно уничтожая С02, получаем
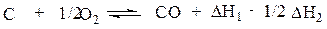
Сравнивая полученное уравнение с искомым, видим, что
DНХ = DН1 - 1/2DН2
Дата добавления: 2016-06-22; просмотров: 2173;











