II закона термодинамики
Второй закон термодинамики, также как и первый, является эмпирическим. Он не имеет теоретических доказательств и обобщает опытные факты, касающиеся процессов взаимоперехода теплоты и работы. Он имеет несколько формулировок (постулатов), которые эквивалентны и вытекают одна из другой.
Некоторые из формулировок наглядны и непосредственно связаны с опытом, другие более абстрактны, но являются более удобными для математического развития теории. Все они выражают одно и то же содержание, подмечая существование самопроизвольных и несамопроизвольных процессов и различие между ними.
Постулат Клаузиуса: теплота не может сама собой переходить от менее нагретого тела к более нагретому, тогда как обратный переход протекает самопроизвольно.
Постулат Томсона: никакая совокупность процессов не может привести к превращению тепла только в работу, тогда как превращение работы в теплоту может быть единственным результатом процесса.
Постулат Оствальда: невозможно построить вечный двигатель второго рода, т.е. двигатель, который производил бы работу только за счет поглощения теплоты из окружающей среды без передачи части теплоты теплоприемнику.
Даже при обратимом процессе в работу может перейти только часть теплоты процесса, другая часть в виде теплоты передается от более нагретых к более холодным частям системы. Это явление называется рассеянием (диссипацией) энергии.
Теплота и работа неравноценны. В случае превращения работы в теплоту происходит превращение согласованного, направленного движения микрочастиц системы в беспорядочное, хаотичное движение. Если же происходит превращение теплоты в работу, хаотичное движение должно перейти в направленное. Естественно, что возникновение порядка из беспорядка более затруднительно.
Рассмотрим процесс превращения теплоты в работу в тепловой машине, действующей обратимо.
| Нагреватель, Т1 |
| Теплоприемник, Т2 |
| Рабочее тело |
| Аобр.= Q1 – Q2 |
| Q1 |
| Q2 |
| Рис. 1.5 |
За один цикл рабочее тело, например, идеальный газ, получает от нагревателя (теплоотдатчика) температурой Т1 некоторое количество теплоты Q1 и совершает работу Аобр. При этом часть теплоты Q2 переходит к теплоприемнику с температурой Т2 (Т1 > Т2). Таким образом, совершаемая рабочим телом работа за один такой цикл эквивалентна разности
Аобр. = Q1 – Q2,
причем Q1 > Q2.
КПД машины h равен
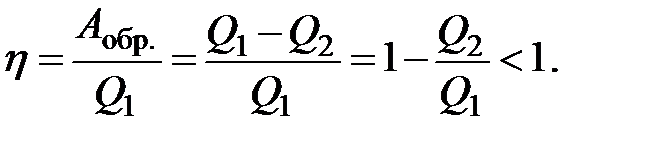
Из полученного соотношения следует, что КПД даже обратимого процесса не может достичь 1, так как часть энергии переходит в состояние, не способное производить работу в условиях рассмотренной системы (она переходит в энергию хаотического движения микрочастиц в теплоприемнике).
Из анализа известного обратимого циклического процесса тепловой машины, включающего два изотермических и два адиабатических этапа расширения и сжатия газа (обратимый цикл Карно), следует, что КПД идеально работающей машины
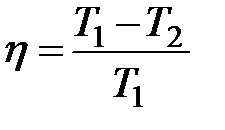
зависит только от температур нагревателя Т1 и теплоприемника Т2. КПД тем больше, чем ниже температура Т2. и больше разница между Т1.и Т2. Он может стать равным 1 при Т2.= 0.
Из равенства
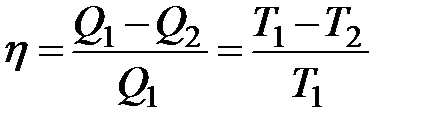
следует, что
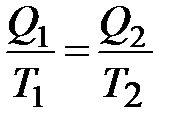 и
и 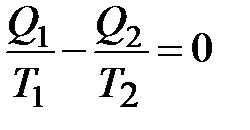 .
.
Отношение Q/T называется приведенной теплотой.
Итак, в обратимых процессах приведенные теплоты нагревателя и теплоприемника одинаковы. Сумма приведенных теплот в цикле Карно равна 0.
Любой произвольный цикл из обратимых процессов может быть заменен суммой бесконечно малых циклов Карно. Можно доказать, что для любого цикла, состоящего из обратимых процессов, сумма приведенных теплот равна 0.
В бесконечно малых величинах указанное свойство запишется
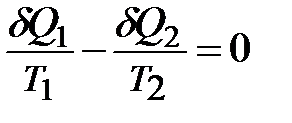 ,
,
| ò |
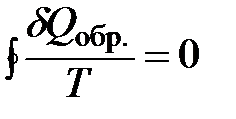 .
.
Из математики известно, что, если интеграл по замкнутому контуру равен 0, то функция, стоящая под знаком интеграла обладает свойствами полного дифференциала, а сама функция представляет собой функцию состояния системы.
Эта функция введена Клаузиусом в 1865 г. и названа энтропией S:
| (1.19) |
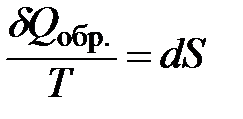
или 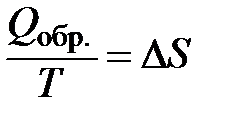 .
.
Выражения (1.19) являются математической записью II закона термодинамики для обратимых процессов.
Дата добавления: 2016-06-22; просмотров: 2899;











