II. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в них атомов и молекул (макроскопические системы). Для исследования этих процессов применяются два качественно различных метода: статистический и термодинамический. Первый лежит в основе молекулярной физики, второй – термодинамики.
Молекулярная физика изучает макроскопические процессы исходя из представлений об атомно-молекулярной природе вещества и рассматривает теплоту как беспорядочное (тепловое) движение атомов и молекул. Тепловое движение определяет внутреннее состояние любого макроскопического тела (системы).
Термодинамика является аксиоматической наукой, она не вводит каких-либо конкретных представлений о строении вещества и физической природе теплоты. Ее выводы основаны на общих принципах или началах, которые являются обобщением опытных фактов. Теплота рассматривается как какое-то внутреннее движение без его конкретизации.
Важным свойством теплового движения является его способность «заставлять» макроскопическую систему «забывать» свое начальное состояние, если исключены меры, поддерживающие начальное состояние. Если систему поместить в неизменные внешние условия, то независимо от начального состояния системы она перейдет в стационарное состояние (не меняющееся со временем). При отсутствии движения через границы системы вещества, энергии, импульса, электрического заряда такое состояние называется состоянием теплового или термодинамического равновесия (равновесное состояние).
Свойства равновесного состояния не зависят от деталей движения отдельных частиц, а определяются поведением всей их совокупности. Это поведение характеризуется небольшим числом величин, называемых термодинамическими параметрами. Равновесное состояние системы характеризуется постоянством во времени ее параметров. Термодинамические параметры определяют некую усредненную картину движения частиц системы, поэтому они имеют смысл средних значений физических величин, описывающих поведение отдельных частиц системы. Это проявляется в существовании статистических флуктуаций значений термодинамических параметров, которые в равновесном состоянии очень малы.
Процесс самопроизвольного перехода системы в равновесное состояние называется релаксацией, а время этого процесса - временем релаксации. До истечения времени релаксации состояние системы остается неравновесным, а сам процесс релаксации является неравновесным.
При изменении внешних условий или воздействии на систему параметры состояния будут изменяться и система перейдет в новое состояние. Этот процесс перехода называется термодинамическим процессом, он может быть равновесным или неравновесным. Процесс называется равновесным, если в ходе его система проходит последовательность равновесных состояний. Равновесными процессами являются бесконечно медленно протекающие процессы (хорошим приближением являются процессы, время протекания которых много больше времени температурной релаксации). Равновесное состояние и равновесный процесс изображаются на диаграмме состояний соответственно точкой и линией.
Рассмотрим основные термодинамические параметры: V – объем системы или тела; Р – давление (абсолютное значение средней силы, действующей со стороны вещества жидкости или газа на каждую из поверхностей помещенной в них единичной площадки); Т – абсолютная температура, характеризует интенсивность теплового движения частиц системы. В случае классического характера движения частиц системы средняя кинетическая энергия поступательного движения одной частицы пропорциональна температуре:
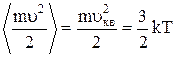 ,
,
где m – масса одной частицы, u – ее скорость, uкв – средняя квадратичная скорость движения молекул, k = 1,38×10-23Дж/К – постоянная Больцмана.
Дата добавления: 2016-07-22; просмотров: 2253;











