Физические и химические свойства элементов главной подгруппы II группы
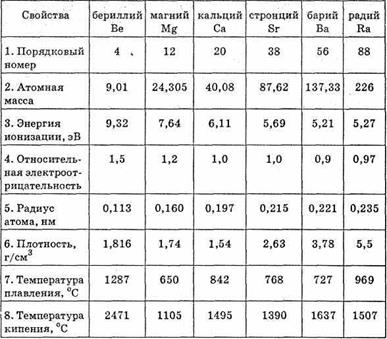
С ростом порядкового номера элемента отдача электронов облегчается, и поэтому металлические свойства закономерно возрастают. Более ярко они проявляются у щелочноземельных металлов.
Следует отметить, что по своим свойствам бериллий и магний несколько отличаются от щелочноземельных металлов кальция, стронция и бария (последний элемент группы радий отличается от остальных щелочноземельных металлов природными радиоактивными свойствами).
Кальций, стронций и барий окисляются на воздухе до оксидов состава RO, поэтому их хранят без доступа воздуха либо в герметически закрытых сосудах, либо под слоем эфира или керосина. Бериллий и магний при комнатной температуре на воздухе покрываются тонкой оксидной пленкой, предохраняющей их от дальнейшего окисления.
Для получения оксидов этих металлов их необходимо поджечь:
Be+O2=ВеО
Кальций, стронций и барий разлагают воду уже при обычной температуре с образованием соответствующих гидроксидов и выделением водорода:
R+2H2O=R(OH)2+H2
Гидроксиды щелочноземельных металлов малорастворимы в воде, их растворимость возрастает от Са(ОН)2 к Ва(ОН)2.
Бериллий с водой не взаимодействует, т.к. образующаяся в первый момент пленка малорастворимого гидроксида бериллия Ве(ОН)2 пассивирует металл. Гидроксид бериллия Ве(ОН)2 имеет амфотерный характер:
Be2++2ОН-«Ве(ОН)2«Н2ВеO2«2Н++BeO2-2
Однако свойства Ве(ОН)2 как основания выражены гораздо отчетливее кислотных.
Магний реагирует с водой лишь при нагревании:
Mg+2Н2O=Mg(OH)2+H2
Гидроксид магния — типичное основание.
При нагревании все металлы главной подгруппы II группы активно реагируют с водородом (давая гидриды RH2, с галогенами, серой, азотом, фосфором, углеродом.
Из металлов этой подгруппы наибольшее значение имеют магний и кальций.
Соли магния и особенно кальция входят в состав многих породообразующих минералов. Из этих горных пород наиболее известны мел, мрамор и известняк, основным веществом которых является карбонат кальция. Карбонаты кальция и магния при нагревании разлагаются на соответствующие оксиды и углекислый газ. С водой, содержащей растворенный диоксид углерода, эти карбонаты реагируют, образуя растворы гидрокарбонатов, например:
MCO3 + CO2 + H2O = M2 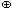 + 2HCO3
+ 2HCO3 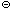 .
.
При нагревании, и даже при попытке выделить гидрокарбонаты из раствора, удаляя воду при комнатной температуре, они разлагаются по обратной реакции:
M2 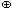 + 2HCO3
+ 2HCO3 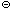 = MCO3
= MCO3  + CO2
+ CO2  + H2O.
+ H2O.
Гидратированный сульфат кальция CaSO4·2H2O представляет собой бесцветное кристаллическое вещество малорастворимое в воде. При нагревании оно частично обезвоживается, переходя в кристаллогидрат состава 2CaSO4·H2O. Тривиальное название двуводного гидрата – гипс, а полуводного – алебастр. При смешивании алебастра с водой он гидратируется, при этом образуется плотная твердая масса гипса. Это свойство алебастра используется в медицине (гипсовые повязки) и строительстве (армированные гипсовые перегородки, заделка дефектов). Скульпторы используют алебастр для изготовления гипсовых моделей и форм.
Карбид (ацетиленид) кальция CaC2. Структурная формула (Ca2 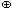 )(
)( 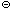 C
C 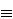 C
C 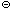 ). Получают спеканием негашеной извести с углем:
). Получают спеканием негашеной извести с углем:
CaO + 3C = CaC2 + CO 
Это ионное вещество не является солью и полностью гидролизуется водой с образованием ацетилена, который долгое время и получали таким способом:
CaC2 + 2H2O = C2H2  + Ca(OH)2.
+ Ca(OH)2.
Гидратированный ион магния [Mg(H2O)6]2  – катионная кислота, поэтому растворимые соли магния подвергаются гидролизу. По этой же причине магний может образовывать основные соли, например, Mg(OH) Cl. Гидратированный ион кальция не является катионной кислотой.
– катионная кислота, поэтому растворимые соли магния подвергаются гидролизу. По этой же причине магний может образовывать основные соли, например, Mg(OH) Cl. Гидратированный ион кальция не является катионной кислотой.
Кальций в соединении может быть обнаружен по окрашиванию пламени. Цвет пламени – оранжево-красный. Качественная реакция на ионы Ca2  , Sr2
, Sr2  и Ba2
и Ba2  , не позволяющая однако различить эти ионы между собой – осаждение соответствующих сульфатов разбавленным раствором серной кислоты (или любым раствором сульфата в кислотной среде):
, не позволяющая однако различить эти ионы между собой – осаждение соответствующих сульфатов разбавленным раствором серной кислоты (или любым раствором сульфата в кислотной среде):
M2  + SO42
+ SO42 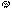 = MSO4
= MSO4  .
.
Кальций и магний незаменимы для человеческого организма. Кальций обеспечивает усвоение организмом железа, помогает при бессоннице, укрепляет кости и скелет, улучшает функцию нервной системы. Его недостаток приводит к размягчению костей, остеопорозу, порче зубов, чувствительности к стрессам, аллергии, судорогам некоторых групп мышц.
Щелочноземельные металлы. Кальций. Это один из пяти (O,C,H,N,Ca) наиболее распространенных элементов в организме человека (1,5%). Основная масса имеющегося в организме кальция находится в костях и зубах в виде фосфата кальция. Внеклеточный кальций влияет на свертываемость крови, нервно-мышечную возбудимость и сердечную мышцу.
Гексагидрат хлорида кальция CaCl2*6H2O используется при аллергических заболеваниях.
Жженый гипс 2CaSO4*H2O получается путём прокаливания природного гипса. При замачивании в воде он быстро твердеет. На этом свойстве основано его использование при изготовлении гипсовых повязок. В стоматологии применяется в качестве слепочного материала при протезировании зубов.
Жёсткость воды и способы её устранения.
Растворимые соли кальция и магния обуславливают общую жёсткость воды. Если они присутствуют в воде в небольших количествах, то вода называется мягкой. При нагревании кислые карбонаты кальция и магния разлагаются и переходят в нерастворимые основные карбонаты: Са(НСО3) = Н2О + СО2 + СаСО3↓ Растворимость сульфата кальция СаSO4 при нагревании также снижается, поэтому он входит в состав накипи. Жёсткость, вызванная присутствием в воде кислых карбонатов кальция и магния, называется карбонатной или временной, так как она может быть устранена. Помимо карбонатной жёсткости, различают ещё некарбонатную жёсткость, которая зависит от содержания в воде ЭСl2 и ЭSO4, где Э – Са, Мg. Эти соли не удаляются при кипячении, и поэтому некарбонатную жёсткость называют также постоянной жёсткостью. Карбонатная и некарбонатная жёсткость в сумме дают общую жёсткость. Для полного ее устранения воду иногда перегоняют. Но это дорого. Для устранения карбонатной жёсткости воду можно прокипятить, но это тоже дорого и образуется накипь. Жёсткость удаляют прибавлением соответствующего количества Са(ОН)2: Са(ОН)2 + Са(НСО3)2 = СаСО3↓ + 2Н2О. Общую жёсткость устраняют или добавлением Na2CO3, или при помощи так называемых катионитов. При использовании углекислого натрия растворимые соли кальция и магния тоже переводят в нерастворимые карбонаты: Са2+ + Na2CO3 = 2Na+ + CaCO3↓. Устранение жёсткости при помощи катионитов – процесс более совершенный. Катиониты – высокомолекулярные натрийсодержащие органические соединения, состав которых можно выразить формулой Na2R, где R – сложный кислотный остаток. При фильтровании воды через слой катионита происходит обмен катионов Na+ кристаллической решетки на катионы Са2+ и Mg2+ из раствора по схеме: Са2+ + Na2R = 2Na+ + CaR. Следовательно, ионы Са из раствора переходят в катионит, а ионы Na+ переходят из катионита в раствор. Для восстановления использованного катионита его промывают концентрированным раствором поваренной соли. При этом происходит обратный процесс: ионы Са2+ в кристаллической решетке в катионита заменяются на ионы Na+ из раствора. Регенерированный катионит снова применяют для очистки воды. Подобным образом работают фильтры на основе пермутита:
магний Na2[Al2Si2O8] + Ca2+ = 2Na+ + Ca[Al2Si2O8]
38. Щелочные металлы: общая характеристика, получение, свойства, важнейшие соединения. Медико-биологическое значение.
Щелочны́е мета́ллы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы)[1]: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr, и унуненний Uue. При растворении щелочных металлов в водеобразуются растворимые гидроксиды, называемые щёлочами.
Дата добавления: 2016-06-22; просмотров: 5051;











