Химические свойства
Подобно атомам углерода, для атомов кремния является характерным состояние sp3-гибридизации орбиталей. В связи с гибридизацией чистый кристаллический кремний образует алмазоподобную решётку, в которой кремний четырёхвалентен. В соединениях кремний обычно также проявляет себя как четырёхвалентный элемент со степенью окисления +4 или −4. Встречаются двухвалентные соединения кремния, например, оксид кремния (II) — SiO.
При нормальных условиях кремний химически малоактивен и активно реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. Такая «неактивность» кремния связана с пассивацией поверхности наноразмерным слоем диоксида кремния, немедленно образующегося в присутствии кислорода, воздуха или воды(водяных паров).
При нагревании до температуры свыше 400—500 °C кремний реагирует с кислородом с образованием диоксида SiO2, процесс сопровождается увеличением толщины слоя диоксида на поверхности, скорость процесса окисления лимитируется диффузией атомарного кислорода сквозь плёнку диоксида.
При нагревании до температуры свыше 400—500 °C кремний реагирует с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHalogen4 и, возможно, галогенидов более сложного состава.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
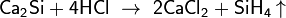
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12.
При восстановлении SiO2 кремнием при температурах свыше 1200 °C образуется оксид кремния (II) — SiO. Этот процесс постоянно наблюдается при производстве кристаллов кремния методами Чохральского, направленной кристаллизации, потому что в них используются контейнеры из диоксида кремния, как наименее загрязняющего кремний материала.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены ещё два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Для травления кремния наиболее широко используют смесь плавиковой и азотной кислот. Некоторые специальные травители предусматривают добавку хромового ангидрида и иных веществ. При травлении кислотный травильный раствор быстро разогревается до температуры кипения, при этом скорость травления многократно возрастает.
1. Si+2HNO3=SiO2+NO+NO2+H2O
2. SiO2+4HF=SiF4+2H2O
3. 3SiF4+3H2O=2H2SiF6+↓H2SiO3
Для травления кремния могут использоваться водные растворы щёлочей. Травление кремния в щелочных растворах начинается при температуре раствора более 60 °C.
1. Si+2KOH+H2O=K2SiO3+2H2↑
2. K2SiO3+2H2O↔H2SiO3+2KOH
Биологическая роль
Для некоторых организмов кремний является важным биогенным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит(1—2)·10−2 % кремния, костная ткань — 17·10−4 %, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Кремний. Микроэлемент. Он жизненно важен для работы и развития высших животных. Повышенным содержанием кремния отличаются ткани, в которых слабо развиты или отсутствуют нервные волокна. Максимальное его количество содержится в коже, хрящах, сухожилиях, в радужной и роговой оболочках глаза.
При повышенном содержании во вдыхаемом воздухе нерастворимых соединений кремния (кремнезём, силикаты) развивается профессиональное заболевание – силикоз у рабочих горнорудной промышленности.
В медицине применяется тальк (3MgO, 4 SiO2*H2O) – присыпка.
Дата добавления: 2016-06-22; просмотров: 2806;











