Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
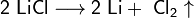
катод: Li+ + e → Li
анод: 2Cl− — 2e → Cl2
2. Иногда для получения щелочных металлов проводят э электролиз расплавов их гидроксидов:
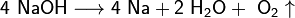
катод: Na+ + e → Na
анод: 4OH− — 4e → 2H2O + O2
3. Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C:

Чтобы реакция пошла в нужную сторону, образующийся свободный щелочной металл (M) должен удаляться путём отгонки. Аналогично возможно восстановление цирконием изхромата. Известен способ получения натрия восстановлением из карбоната углём при 1000 °C в присутствии известняка.
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
Соединения щелочных металлов
Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрияэлектролизом концентрированного водного раствора поваренной соли:
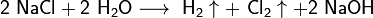
катод: 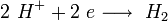
анод: 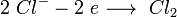
Прежде щёлочь получали реакцией обмена:

Получаемая таким способом щёлочь была сильно загрязнена содой Na2CO3.
Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных дляоснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
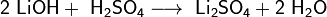
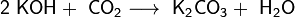
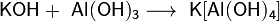
Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который так же, как гидроксиды металлов главной подгруппы II группы, при прокаливании разлагается на оксид и воду:
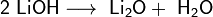
Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола.
Карбонаты
Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26 — 30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой:
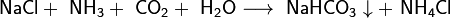
Аммиак добавляют для нейтрализации кислотной среды, возникающей при пропускании углекислого газа в раствор, и получения гидрокарбонат-иона HCO3−, необходимого для осаждения гидрокарбоната натрия. После отделения питьевой соды раствор, содержащий хлорид аммония, нагревают с известью и выделяют аммиак, который возвращают в реакционную зону:
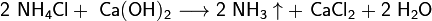
Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
При прокаливании гидрокарбоната натрия получается кальцинированная, или стиральная, сода Na2CO3 и диоксид углерода, используемый в процессе получения гидрокарбоната натрия:
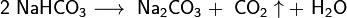
Основной потребитель соды — стекольная промышленность.
В отличие от малорастворимой кислой соли NaHCO3, гидрокарбонат калия KHCO3 хорошо растворим в воде, поэтому карбонат калия, или поташ, K2CO3 получают действиемуглекислого газа на раствор гидроксида калия:
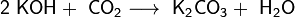
Поташ используют в производстве стекла и жидкого мыла.
Щелочные металлы. Ионы Na+ и К+ распределены по всему организму, причём ионы натрия входят в состав преимущественно межклеточных жидкостей, а ионы калия находятся, в основном, внутри клеток. С ионами натрия связаны осмотическое давление жидкостей, удержание воды тканями, поддержание кислотно-основного равновесия в организме, перенос аминокислот и сахаров через клеточную мембрану.
Хлорид натрия NaCl. В зависимости от концентрации хлорида натрия различают изотонический (физиологический) и гипертонический растворы.
Изотоническим является 0,9%-ный раствор NaCl, т.к. его осмотическое давление соответствует осмотическому давлению плазмы крови (7,7 атм). Изотонический раствор используют в качестве плазмозаменяющего раствора при обезвоживании организма, для растворения лекарственных веществ и т.д. Гипертонические растворы (5%, 10%)применяют наружно в виде компрессов и примочек для лечения гнойных ран.
Гидрокарбонат натрия NaHCO3 (питьевая сода). Введение гидрокарбоната натрия в желудок приводит к быстрой нейтрализации соляной кислоты желудочного сока:
NaHCO3 + HCl = NaCl + H2O + CO2
Глауберова соль Na2SO4*10H2O; назначается внутрь в качестве слабительного средства.
Иодид калия KI применяется как препарат йода при заболеваниях щитовидной железы.
Перманганат калия KMnO4 используется как антисептическое средство для промывания ран, полоскания рта и горла.
Дата добавления: 2016-06-22; просмотров: 8704;











