Влияние температуры на скорость реакции
Температура оказывает сильное влияние на скорость химической реакции. В соответствии с эмпирическим правилом Вант-Гоффа с увеличением температуры на каждые 10 °С скорость химической реакции увеличивается приблизительно в 2 – 4 раза:
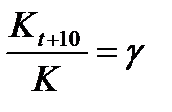 ,
,
где g - температурный коэффициент скорости химической реакции.
Ответ на вопрос, почему температура так сильно влияет на скорость реакции, дает теория активных соударений Аррениуса.
Согласно теории Аррениуса к единичному акту химического взаимодействия приводят не все соударения молекул реагирующих веществ, а только активные соударения. Активным соударением называется такое соударение, в результате которого молекулы реагирующих веществ получают избыточную (дополнительную) энергию, которую называют энергией активации. Доля активных соударений от общего числа столкновений невелика и составляет
10-20 – 10-10. Скорость реакции пропорциональна количеству активных соударений; с повышением температуры тепловое движение молекул интенсифицируется, в результате доля активных соударений молекул увеличивается, а, следовательно, увеличивается скорость реакции.
Энергия активации – это минимальное значение избыточной энергии, получаемое молекулами в момент соударения, достаточное для протекания элементарного акта химического взаимодействия. Эта энергия ослабляет существующие химические связи между атомами в молекулах и способствует перераспределению связей, то есть приводит к химическому взаимодействию. Энергия активации не зависит от температуры, а определяется только природой реагирующих веществ и характером химического взаимодействия.
| U |
| Координата реакции |
| U1 |
| U2 |
| Еа1 |
| Еа2 |
| ΔU |
Как видно из рис., тепловой эффект реакции равен
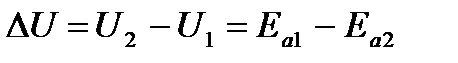 .
.
Запишем уравнение изохоры химической реакции
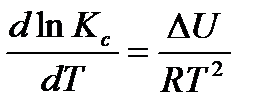 ,
,
где Кс – константа химического равновесия.
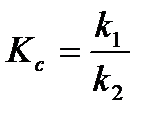 ,
,
где k1, k2 – константа скорости прямой и обратной реакций соответственно.
Подставим в уравнение изохоры выражения для Кс и ∆U:
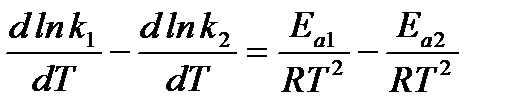 .
.
С математической точки зрения полученное уравнение справедливо лишь в том случае, если
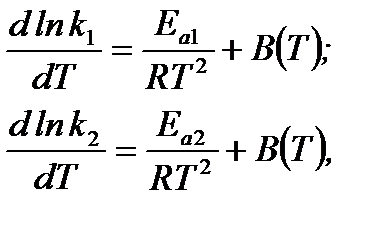
где В(Т) – некоторая постоянная, имеющая одно и то же значения для прямой и обратной реакций, зависящая от температуры.
Аррениус доказал, что для химических реакций В(Т) = 0, тогда
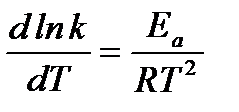 ,
,
где k – константа скорости реакции;
Еа – энергия активации.
Полученное уравнение называется уравнением Аррениуса.
Разделим переменные и проинтегрируем уравнение Аррениуса:
| lnk |
| 1/T |
| i |
| α |
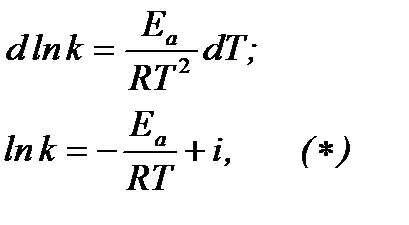
где i – константа интегрирования.
Из полученного уравнения следует, что для любой химической реакции зависимость lnk от 1/Т выражается прямой линией. Тангенс угла наклона прямой равен
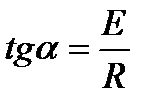 .
.
Преобразуем уравнение (*):
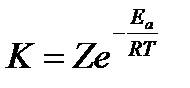 ,
,
где 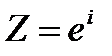 – предэкспоненциальный множитель.
– предэкспоненциальный множитель.
Энергия активации и предэкспоненциальный множитель – важнейшие характеристики химической реакции. Для расчета энергии активации и предэкспоненциального множителя достаточно знать константу скорости реакции при двух температурах.
При интегрировании уравнения Аррениуса в интервале температур от T1 до Т2 получаем уравнение, которое часто применяют в расчетах:
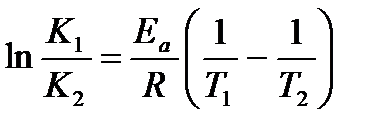 .
.
Основные понятия катализа
Катализ – явление ускорения реакций в присутствии веществ – катализаторов, которые присутствуют в реакционной смеси и увеличивают скорость реакции, но сами не претерпевают никаких изменений в результате ее протекания. Вещества, уменьшающие скорость реакции называются ингибиторами.
Катализаторы не оказывают влияния на изменение энергии Гиббса и константу равновесия химической реакции, но могут сильно влиять на константу скорости реакции. Катализатор целесообразно применять для ускорения экзотермических реакций, так как повышение температуры при протекании таких реакций способствует смещению равновесия в сторону исходных веществ и уменьшению выхода продуктов реакции.
Действие каждого катализатора специфично, то есть определенные катализаторы оказывают влияние лишь на некоторые реакции. Например, серебро ускоряет реакции окисления. Для ускорения реакции достаточно очень малого количества катализатора. Смесь катализаторов часто действует значительно сильнее по сравнению с действием отдельных катализаторов.
При формальном подходе к каталитическим явлениям можно сказать, что механизм воздействия положительного катализатора заключается в снижении энергии активации реакции, а отрицательного – в увеличении.
Различают гомогенный, гетерогенный и ферментативный катализ. При гомогенном катализе катализатор и реакционная смесь составляют одну фазу, а при гетерогенном – разные фазы. При ферментативном катализе катализаторами служат вещества белковой природы (ферменты).
В основу гомогенного катализа положена теория промежуточного соединения, согласно которой катализатор образует с реагирующими веществами нестойкие промежуточные соединения, которые распадаются с образованием продуктов реакции и выделением катализатора в неизменном виде. Указанные процессы протекают быстрее, чем химическая реакция в отсутствии катализатора.
На скорость гетерогенно-каталитического процесса сильно влияет площадь поверхности катализатора. Чем больше площадь поверхности, тем выше скорость процесса. Кроме того, на скорость гетерогенного катализа влияет состояние поверхности катализатора, а именно наличие активных центров – различного рода неоднородностей, обусловленных химическим составом, кристаллической структурой и т.д. Для создания активных центров на поверхности катализатора ее обрабатывают специальными веществами, который называются промоторами. При использовании катализатора его активность постепенно снижается. Вещества, снижающие активность катализатора называют каталитическими ядами.
Дата добавления: 2016-06-22; просмотров: 3360;











