Реакция нулевого порядка
Это реакции, скорость которых не зависит от концентрации реагирующих веществ. Основной закон химической кинетики для реакции нулевого порядка записывается:
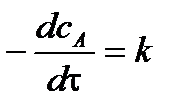
Разделим переменные и проинтегрируем в
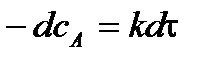 ,
,
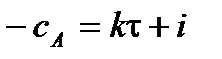 ,
,
где i – константа интегрирования.
Если τ = 0, то 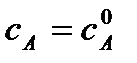 – начальная концентрация вещества А в момент времени
– начальная концентрация вещества А в момент времени
τ = 0, тогда константа интегрирования равна:
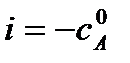
С учетом этого решим уравнение относительно k:
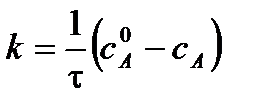 .
.
Зная константу скорости реакции, можно рассчитать концентрацию реагирующих веществ в любой момент времени:
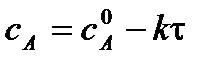
Для характеристики скорости реакции применяется понятие времени полупревращения или полураспада τ1/2. Это есть время, за которое прореагирует половина взятого количества вещества. С учетом того, что 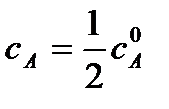 получим
получим
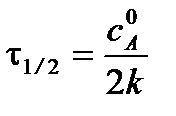
Время полупревращения реакции нулевого порядка прямо пропорционально концентрации исходного вещества.
Реакция 1 порядка: А ® В.
Пусть объем реакционной смеси равен V. Пусть в начальный момент времени τ = 0 в реакционной смеси содержится а моль вещества А и 0 моль вещества В. В момент времени τ в реакционной смеси а – х моль вещества А и х моль вещества В.
Уравнение скорости химической реакции 1 порядка имеет вид
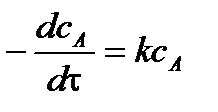 .
.
Концентрация вещества А равна
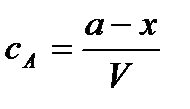 ,
,
тогда
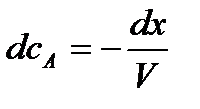 .
.
Подставим в уравнение и разделим переменные:
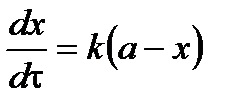 ,
,
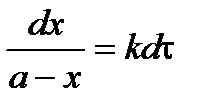 .
.
Из последнего уравнения следует, что скорость реакции 1 порядка не зависит от объема реакционной смеси.
Проинтегрировав, получим
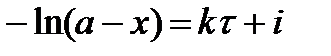 ,
,
где i – константа интегрирования.
При τ = 0 – х = 0, тогда
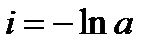
С учетом этого решим уравнение относительно k:
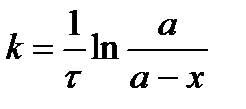 .
.
Разделив числитель и знаменатель на V, получим
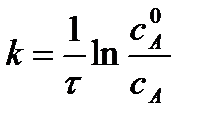 ,
,
Решим уравнение относительно 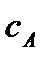 :
:
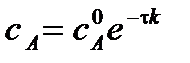 .
.
Время полупревращения реакции 1 порядка равно
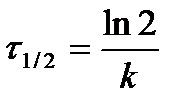 .
.
Как видно, время полупревращения реакции 1 порядка не зависит от концентрации исходного вещества и обратно пропорционально константе скорости реакции.
Реакция 2 порядка: A + B ® C + D.
Пусть в объеме реакционной смеси V в начальный момент времени
(τ = 0) содержится а моль вещества А и b моль вещества В, а вещества С и D отсутствуют. В момент времени τ по х моль веществ вступило в реакцию и образовалось по х моль веществ С и D, то есть в реакционной смеси а – х моль вещества А, b – х моль вещества В, х моль вещества С и х моль вещества D.
Запишем уравнение для скорости реакции
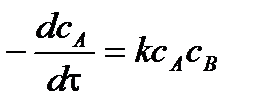
Текущие концентрации реагирующих веществ:
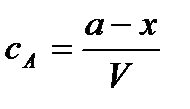 ;
; 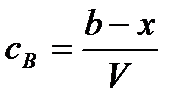 .
.
Производная от 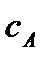 равна
равна
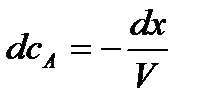 ,
,
тогда
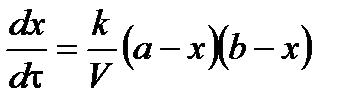 .
.
Скорость реакции 2 порядка обратно пропорциональна объему реакционной смеси. Преобразуем уравнение:
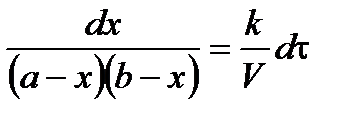 (*);
(*);
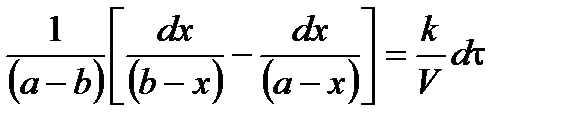
Проинтегрируем в неопределенных пределах
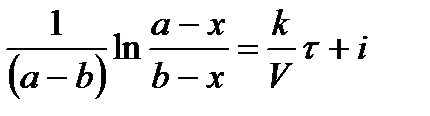 .
.
При τ = 0 – х = 0, тогда
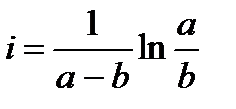
Подставим значение константы интегрирования и решим уравнение относительно k:
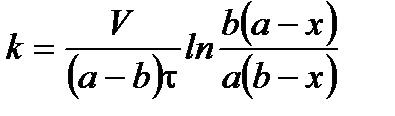
Поделим на V числитель и знаменатель правой части уравнения, а дробь, стоящую под знаком логарифма на V2, получим
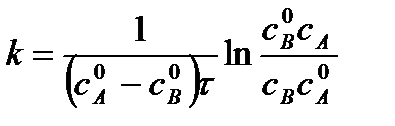 ,
,
где 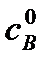 – исходная концентрация вещества В.
– исходная концентрация вещества В.
Полученное уравнение неприменимо для случая, когда 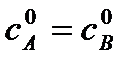 . Рассмотрим этот случай. Если a = b, то уравнение (*) запишется в виде:
. Рассмотрим этот случай. Если a = b, то уравнение (*) запишется в виде:
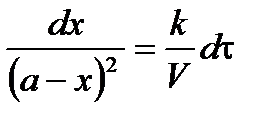
После интегрирования получим
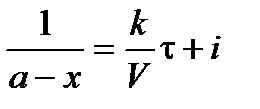
При τ = 0 – х = 0, тогда
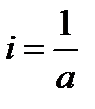 .
.
Подставим и решим уравнение относительно k:
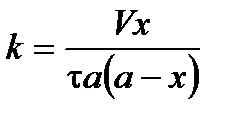 .
.
Поделим на V2:
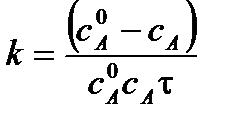 .
.
Текущую концентрацию вещества А можно рассчитать по формуле:
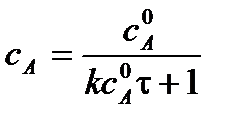 .
.
Время полупревращения вещества для реакции 2 порядка при a = b рассчитывается по уравнению:
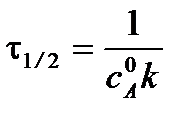 .
.
Дата добавления: 2016-06-22; просмотров: 2297;











