Механизм возникновения электродных потенциалов и их расчет
| Ме |
| раствор |
| – |
| – |
| – |
| – |
| – |
| + |
| + |
| + |
| + |
| + |
Если химический потенциал катионов металла в узлах кристаллической решетки больше чем в растворе, то часть ионов перейдет с поверхности пластины в раствор.
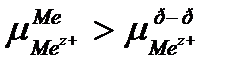
| Ме |
| раствор |
| + |
| + |
| + |
| + |
| + |
| – |
| – |
| – |
| – |
| – |
Если 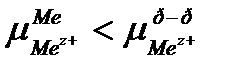 , то вследствие выравнивания химических потенциалов катионы из раствора будут переходить на поверхность металла и заряжать ее положительно, а у поверхности будут концентрироваться анионы. В результате так же образуется ДЭС и возникает скачок потенциала между положительно заряженной пластиной и слоем анионов.
, то вследствие выравнивания химических потенциалов катионы из раствора будут переходить на поверхность металла и заряжать ее положительно, а у поверхности будут концентрироваться анионы. В результате так же образуется ДЭС и возникает скачок потенциала между положительно заряженной пластиной и слоем анионов.
Поставим задачу рассчитать величину потенциала электрода, в основе работы которого лежит окислительно-восстановительная реакция:
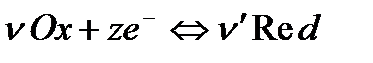 ,
,
где Ox – окисленная форма вещества;
Red – восстановленная форма вещества;
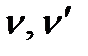 – стехиометрические коэффициенты;
– стехиометрические коэффициенты;
z – число электронов, принимающих участие в реакции.
Пусть в результате работы электрода произошло восстановление 1 моля вещества, тогда в соответствии с законом Фарадея была совершена электрическая работа:
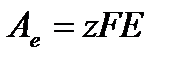 ,
,
где F – постоянная Фарадея;
Е – потенциал электрода.
Совершенная электрическая работа равна термодинамической работе обратимого электрода. С учетом того, что 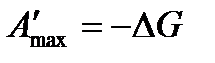 , а мольная энергия Гиббса – это химический потенциал получаем
, а мольная энергия Гиббса – это химический потенциал получаем
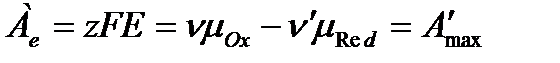 .
.
Все ионы и молекулы, принимающие участие в электродных реакциях называются потенциалопределяющими. Выразим их химические потенциалы через термодинамические активности:
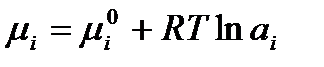 ,
,
тогда
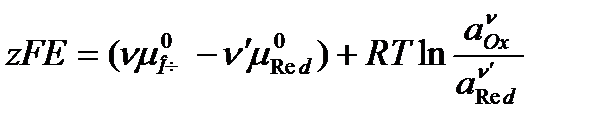
Решим уравнение относительно Е:
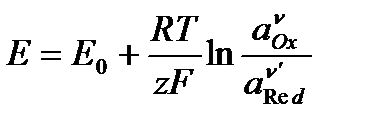 – уравнение Нернста,
– уравнение Нернста,
где Е0 – стандартный электродный потенциал:
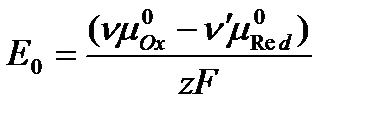 .
.
Стандартный электродный потенциал Е0 – это величина потенциала электрода в стандартном состоянии, когда термодинамические активности всех потенциалопределяющих ионов и молекул равны единице.
Абсолютные значения скачков потенциала на границе металл – раствор определить невозможно. Поэтому стандартный электродный потенциал принимается равным ЭДС гальванического элемента, состоящего из данного электрода и другого электрода, который во всех случаях один и тот же. В качестве такого электрода выбран водородный электрод с активностью ионов водорода в растворе, равной единице, а его электродный потенциал принят равным нулю. Электродный потенциал данного электрода считается положительным, если он является положительным полюсом этого элемента и наоборот. Стандартные электродные потенциалы важнейших электродов приведены в справочной литературе.
Дата добавления: 2016-06-22; просмотров: 3111;











