Методы определения порядка реакции
Из предыдущего раздела следует, что для создания математической модели химической реакции необходимо знать ее порядок.
Существует несколько методов определения порядка реакции.
1. Метод подстановки. Сущность метода заключается в эмпирическом подборе такого кинетического уравнения, которое лучшим образом описывает результаты эксперимента. Существует два варианта реализации метода подстановки.
1) Аналитический метод, заключающийся в том, что для описания экспериментальных данных используются уравнения для реакций различных порядков и выбирается то уравнение, которое наилучшим образом описывает результаты эксперимента. Для этого по опытным значениям концентраций в различные моменты времени рассчитывают константу скорости реакции первого, второго и т.д. порядка. Уравнение удовлетворительно описывает процесс, если рассчитанные по нему значения констант колеблются около какой-либо средней величины и отклонения от среднего лежат в пределах погрешности определения.
2) Графический метод. Зависимость концентрации во времени для реакций различных порядков может быть выражена прямой линией, если подобрать соответствующую систему координат. Так для реакции нулевого порядка зависимость концентрации реагирующего вещества от времени имеет линейный вид:
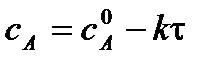
| τ |
| сА |
| α |
| β |
Для реакции 1-го порядка прямая получается в системе координат lnС = f(t):
| lnсА |
| α |
| β |
| τ |
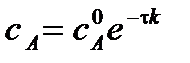
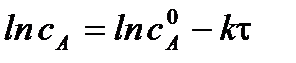
Для реакции 2-го порядка при 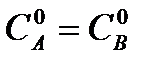 линейная зависимость в координатах
линейная зависимость в координатах
1/С = f(t):
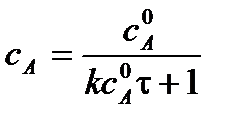 ;
;
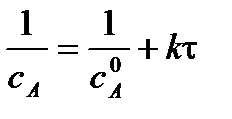
| τ |
| τ |
| 1/сА |
| α |
Подбирается случай, когда зависимость в соответствующих координатах прямолинейная. По тангенсу угла наклона можно определить значение константы скорости.
Недостаток метода подстановки заключается в его трудоемкости.
2. Графический метод. Запишем кинетическое уравнение в виде:
| lgW |
| lgK |
| lgс |
| a |
| n = tga |
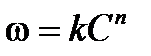 ,
,
прологарифмируем
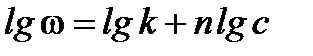 .
.
Полученное уравнение является линейным, поэтому порядок реакции n будет равен тангенсу угла наклона прямой.
Недостаток метода заключается в необходимости определения абсолютной скорости реакции, что может привести к ошибкам.
3. Метод Вант-Гоффа.
| a |
| С |
| t |
| С |
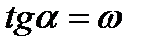 . Тогда:
. Тогда:
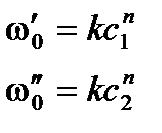 ,
,
где ω0² - скорость реакции при исходной концентрации реагирующего вещества с2;
ω0¢ - скорость реакции при исходной концентрации реагирующего вещества с1.
Логарифмируя уравнения, почленно вычитая их друг из друга и решая относительно n, получим:
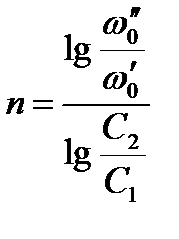
Метод Вант-Гоффа достаточно точен.
5. Метод избыточных концентраций (Оствальда). Основан на исследовании зависимости скорости реакции от начальной концентрации какого-либо одного реагента. Для этого в опытах меняется начальная концентрация одного реагента, а другие исходные вещества берутся в большом избытке – тогда концентрации этих веществ можно принять постоянными. Порядок по первому реагенту определяется по одному из вышеуказанных методов. Затем проводят аналогичные опыты с переменной начальной концентрацией другого исходного вещества в избытке остальных. Общий порядок реакции равен сумме порядков по отдельным компонентам.
Дата добавления: 2016-06-22; просмотров: 4960;











