Основные типы электродов и расчет их потенциала
Различают следующие типы электродов
1) Электроды I рода – металлические, представляющие собой металл, погруженный в раствор соли металла: Ме/Ме+z
Реакции, протекающие на электродах, принято записывать так, чтобы в левой части уравнения находились окисленные формы реагирующих веществ, а в правой – восстановленные. В основе работы электрода I рода лежит реакция:
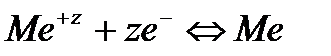 .
.
Применим уравнение Нернста для расчета потенциала электрода:
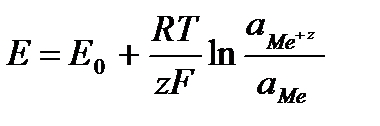 .
.
В электрохимии стандартные состояния выбирают таким образом, что активность нейтральных металлов равна единице: 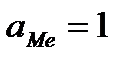 , тогда
, тогда
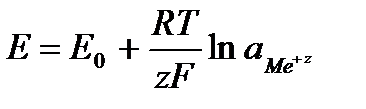 .
.
Потенциал электрода I рода определяется термодинамической активностью ионов данного металла в растворе, поэтому электроды I рода обратимы относительно катиона. К электродам I рода относятся цинковый, медный электроды и т.д.
2) Электроды II рода представляют собой металлическую пластину, покрытую слоем труднорастворимой соли данного металла и погруженную в раствор, содержащий анионы труднорастворимой соли: Ме, MeAn/An-z
В основе работы электрода II рода лежит реакция:
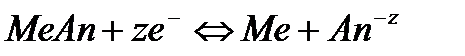 .
.
Применяя уравнение Нернста с учетом выбранного стандартного состояния, получаем:
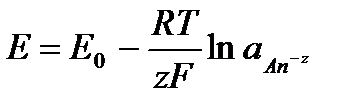
Электроды II обратимы относительно аниона. Основными представителями электродов II рода являются хлорсеребряный и каломельный электроды, которые на практике часто применяют в качестве электродов сравнения, в частности при измерении рН растворов.
3) Газовые электроды – электроды, состоящие из инертного металла, контактирующего одновременно с газом и раствором, содержащим ионы газообразного вещества. Типичным представителем газовых электродов является водородный электрод, представляющий собой платиновую пластинку, покрытую слоем электролитической платины для обеспечения достаточной площади поверхности и опущенную в раствор, содержащий ионы водорода, при этом через раствор непрерывно пропускается газ, содержащий молекулярный водород.
В основе работы водородного электрода лежит реакция:
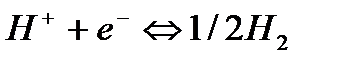 .
.
Применим уравнение Нернста:
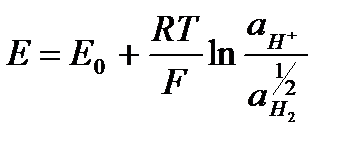 .
.
Если принять, что активность молекулярного водорода равна парциальному давлению, то
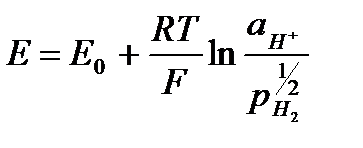 .
.
Если 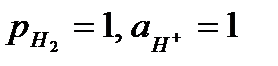 , то такой электрод является стандартным и его потенциал равен нулю:
, то такой электрод является стандартным и его потенциал равен нулю:
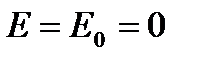
4) Амальгамные электроды представляют собой металлическую пластину, покрытую слоем амальгамного металла (т.е. раствора данного металла в ртути) и опущенную в раствор, содержащий ионы данного металла:
Ме, Ме(Hg)/Me+z.
В основе работы амальгамного электрода лежит реакция:
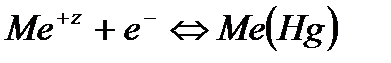
Уравнение для расчета потенциала амальгамного электрода имеет вид:
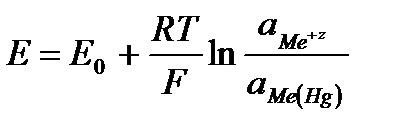 .
.
5)Электроды III рода или окислительно-восстановительные электроды, представляют собой пластину из инертного металла, например, платины, погруженную в раствор, содержащий окисленные и восстановленные формы веществ (ионов или молекул). Характерной особенностью таких электродов является то, что процесс окисления-восстановления протекает в растворе без участия вещества самого металлического электрода, который играет роль проводника электрического тока: Pt/Ox, Red.
Например, ферро-ферри электрод: Pt/Fe3+, Fe2+
В основе работы такого электрода лежит реакция:
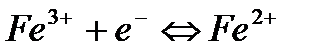
Уравнение для расчета потенциала электрода имеет вид:
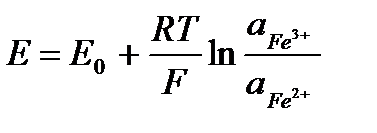 .
.
Раздел V. химическая кинетика и катализ
Химическая кинетика – наука о скорости протекания химических реакций.
Скорость химической реакции – изменение концентрации одного из реагирующих веществ в единицу времени.
Поскольку в реакциях вещества участвуют в стехиометрических соотношениях, за скорость реакции может быть принята производная от концентрации любого из реагирующих веществ по времени:
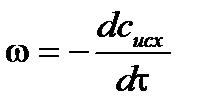 ,
,
где сисх – концентрация исходного вещества;
t – время.
Если в качестве одного из реагирующих веществ выбран продукт реакции, то
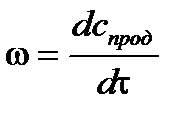
Скорость реакции всегда положительна, поэтому для исходных веществ, концентрация которых убывает, производную берут со знаком «–».
Скорость реакции в момент времени t равна тангенсу угла наклона касательной, проведенной к кривой зависимости с = f(t) в точке, соответствующей времени t:
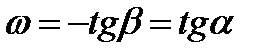 – для исходных веществ
– для исходных веществ
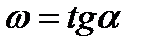 – для продуктов реакции.
– для продуктов реакции.
Среднюю скорость реакции за промежуток времени ∆τ можно рассчитать:
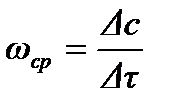
| t1 |
| a |
| с |
| t |
| b |
| a |
| спрод |
| сисх |
| ∆t |
| ∆С |
| с1 |
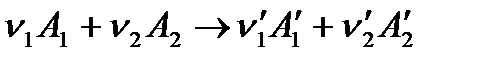 (*)
(*)
скорость можно выразить
 .
.
Дата добавления: 2016-06-22; просмотров: 4631;











