Составление уравнений окислительно-восстановительных реакций
Метод электронного баланса. В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, равно числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах.
Пример 1. Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой.
Запишем формулы исходных веществ и продуктов реакции:
 .
.
Покажем изменение степеней окисления атомов до и после реакции:
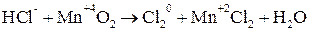 .
.
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. Составляем электронные уравнения:

 восстановитель
восстановитель  2 1 окисление,
2 1 окисление,
окислитель 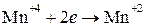 2 1 восстановление
2 1 восстановление
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления «-1» отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
 .
.
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль 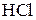 приходится 1 моль
приходится 1 моль 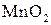 . Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид:
. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид:
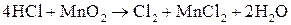 .
.
Окончательно правильность составленного уравнения реакции контролируют по числу атомов кислорода. Так, в приведенной реакции в левой части атомов кислорода 2, в правой – тоже 2. Следовательно, уравнение составлено верно.
Пример 2. Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции – формулы исходных и полученных веществ:
 .
.
Затем покажем изменение степеней окисления атомов до и после реакции:
 .
.
Изменяются степени окисления у атомов серы и марганца. Составляем электронные уравнения:

 восстановитель
восстановитель 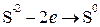 2 5 окисление,
2 5 окисление,
окислитель 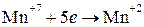 5 2 восстановление
5 2 восстановление
И, наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль  и 2 моль
и 2 моль  , тогда получим 5 моль
, тогда получим 5 моль 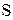 и 2 моль
и 2 моль  . Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль
. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль 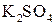 и 8 моль воды. Окончательное уравнение реакции будет иметь вид:
и 8 моль воды. Окончательное уравнение реакции будет иметь вид:
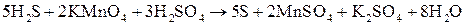 .
.
Правильность написания уравнения подтверждается подсчетом атомов кислорода; в левой части их 2 ∙ 4 + 3 ∙ 4 = 20 и в правой части 2 ∙ 4 + 4 + 8 = 20.
Дата добавления: 2020-03-21; просмотров: 810;











