ТЕМА 6. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Окислительно-восстановительные процессы относятся к числу распространенных химических реакций. Дыхание, усвоение СО2 растениями с выделением О2, обмен веществ и ряд биологических процессов в основе своей имеют окислительно-восстановительные реакции.
Сжигание топлива в двигателях внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумуляторах, включают реакции окисления-восстановления.
Получение металлов, простых веществ, ценных химических продуктов (аммиака, щелочей, HNO3,H2SO4), производство строительных материалов, пластмасс, медикаментов основано на окислительно-восстановительных процессах.
Основные понятия
Реакции, в результате которых изменяются степени окисления элементов, называются окислительно-восстановительными.
Например,
 .
.
Любая окислительно-восстановительная реакция состоит из двух процессов, или полуреакций: окисления и восстановления. Реакция 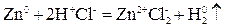 состоит из двух полуреакций:
состоит из двух полуреакций:
окисление цинка 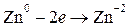
и восстановление водорода 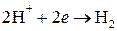 .
.
Вещества, входящие в полуреакцию, образуют сопряженную пару. Один из их компонентов называют окисленной формой – Ох, другой – восстановленной формой – Red.
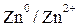 ;
; 
Ox Red Ox Red
Окисленная форма образована элементом в более высокой степени окисления, восстановленная форма – элементом в более низкой степени окисления. Степень окисления изменяется у Zn от 0 до +2, у водорода от +1 до 0. Продуктами реакции являются новые окислитель и восстановитель, более слабые, чем исходные:
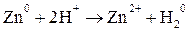
Ox1 + Red2 → Ox1 + Red2
Окисление – это процесс отдачи электронов атомом, молекулой или ионом.
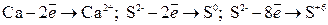 .
.
Атом, молекула или ион, отдающий электроны называется восстановителем.
Восстановление – процесс присоединения электронов атомом, молекулой, ионом
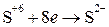 ;
; 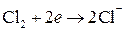 ;
; 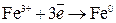 .
.
Атом, молекула или ион, принимающий электроны называется окислителем.
В большинстве случаев происходит не перенос электронов, а смещение электронного облака, поэтому правильнее говорить об изменении электронной плотности.
Степень окисления – это условно приписываемые заряды, которые могут приобрести атомы элемента, если бы они отдали или присоединили некоторое число электронов.
Степень окисления может иметь положительное, нулевое и отрицательное значение.
Величина положительной степени окисления определяется числом электронов, оттянутых от данного атома. Обозначается «+».
Отрицательнаястепень окисления приписывается атомом, притянувшим к себе электроны равной числу притянутых электронов и обозначается «–».
Дата добавления: 2020-03-21; просмотров: 617;











