Влияние среды на характер протекания реакций
Реакции окисления – восстановления могут протекать в различных средах: в кислой (избыток ионов Н+), нейтральной (Н2О) и щелочной (избыток гидроксид-ионов ОН-). В зависимости от среды может меняться характер протекания между одними и теми же веществами. Среда влияет на изменение степеней окисления атомов. Так, например, ион 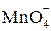 в кислой среде восстанавливается до
в кислой среде восстанавливается до 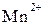 , в нейтральной – до
, в нейтральной – до 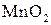 , а в щелочной – до
, а в щелочной – до 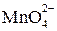 . Схематически эти изменения можно представить так:
. Схематически эти изменения можно представить так:
| Окисленная форма | Среда раствора | Восстановленная форма |
| Н+ | Mn2+ (бесцветный раствор) | |
| MnO4- | Н2О | MnO2 (бурый осадок) |
| ОН- | MnO42- (раствор зеленого цвета) |
Обычно для создания в растворе кислой среды используют серную кислоту. Азотную и соляную кислоты применяют редко: первая сама является окислителем, вторая способна окисляться. Для создания щелочной среды применяются растворы гидроксидов калия или натрия. Руководствуясь приведенной схемой, составим методом полуреакций уравнения реакции взаимодействия сульфита натрия Na2SO4 (восстановитель) с перманганатом калия KMnO4 (окислитель) в различных средах (примеры 1-3).
Пример 1. В кислой среде:
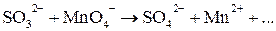

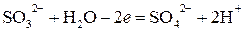 5
5
 2
2
_________________________________________________________________
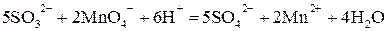
или
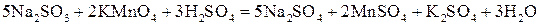
Пример 2. В нейтральной или слабокислой среде:


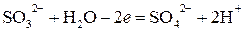 3
3
 2
2
_________________________________________________________________________________

или
 .
.
Пример 3. В сильнощелочной среде:
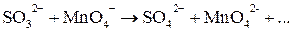

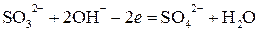 1
1
 2
2
_______________________________________________________________________________
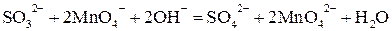
или
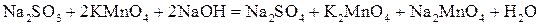 .
.
Методика составления уравнений окислительно-восстановительных реакций, для которых заведомо известны их начальные и конечные продукты, представляет собой лишь первый этап их изучения.
Весьма важным является определение самой возможности протекания окислительно-восстановительной реакции и установление ее продуктов даже при наличии двух веществ, из которых одно может выполнить функцию восстановителя или окислителя по отношению к другому. Приступая к уравнению реакции, необходимо, прежде всего, выяснить, какие вещества могут выполнить в ней функцию окислителя и восстановителя, каковы возможные продукты реакции и влияние на них характера среды – нейтральной, кислой или щелочной.
Ниже рассмотрены некоторые важнейшие типы окислителей и восстановителей.
Дата добавления: 2020-03-21; просмотров: 574;











