Метод полуреакций, или ионно-электронный метод.
Этот метод применим только для окислительно-восстановительных реакций, протекающих в растворах электролитов, то есть с участием ионов. При составлении уравнений необходимо учитывать среду, в которой протекает реакция.
Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса (см. пример 2). При пропускании сероводорода  через подкисленный раствор перманганата калия
через подкисленный раствор перманганата калия  малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т. е. протекания процесса:
малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т. е. протекания процесса:
 .
.
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
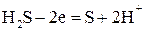 .
.
Это первая полуреакция – процесс окисления восстановителя  . Обесцвечивание раствора связано с переходом иона
. Обесцвечивание раствора связано с переходом иона 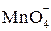 (он имеет малиновую окраску) в ион
(он имеет малиновую окраску) в ион 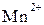 (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой:
(практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой:
 .
.
В кислом растворе кислород, входящий в состав иона 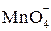 , вместе с ионами водорода образует воду. Поэтому процесс перехода записываем так:
, вместе с ионами водорода образует воду. Поэтому процесс перехода записываем так:

Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (+7), а конечные – два положительных (+2), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:

Это вторая полуреакция – процесс восстановления окислителя, т. е. перманганат-иона 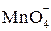 .
.
Для составления общего уравнения реакции надо уравнения полуреакций сложить, предварительно уравняв числа отданных и полученных электронов. Для этого по правилам наименьшего кратного определяют соответствующие множители, на которые умножают уравнения полуреакций. Сокращенно запись проводится так:

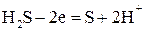 5
5
 2
2
___________________________________________________________________________________________
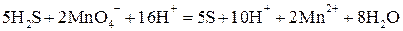
И, сократив на  , окончательно получим:
, окончательно получим:
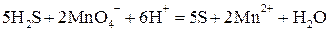 .
.
Записываем уравнение в молекулярной форме и подбираем коэффициенты перед формулами остальных веществ:
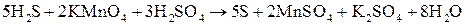 .
.
Таким образом, составление уравнений окислительно-восстановительных реакций с помощью метода полуреакций приводит к тому же результату, что и метод электронного баланса.
Сопоставим оба метода. Достоинство метода полуреакций по сравнению с методом электронного баланса в том, что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионов  ,
,  ,
, 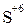 ,
, 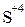 , а есть ионы
, а есть ионы 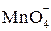 ,
, 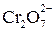 ,
, 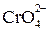 ,
, 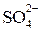 ,
, 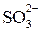 . При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все продукты реакции, они появляются в уравнении реакции при его выводе. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах.
. При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все продукты реакции, они появляются в уравнении реакции при его выводе. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах.
Дата добавления: 2020-03-21; просмотров: 782;











