Первый закон термодинамики
Основы химической термодинамики
Термодинамика – Наука о взаимном превращении одних видов энергии в другие.
Различают общую, техническую и химическую термодинамику.
Общая термодинамика рассматривает теоретические основы всех направлений термодинамики.
В технической термодинамике рассматриваются взаимные превращения теплоты и работы применительно, главным образом, к конструированию и эксплуатации тепловых двигателей.
Химическая термодинамика – раздел физической химии, в котором термодинамические методы применяются для анализа химических и физико-химических процессов – химических реакций, фазовых переходов, явлений в растворах и т.п.
Основные понятия, используемые в химической термодинамике
Объектом изучения термодинамики является термодинамическая система.
Термодинамическая система (или просто система) – это тело или совокупность тел, выделяемых в пространстве с помощью реально существующей или воображаемой границы. Иными словами, система – это та часть материального мира, которая является предметом нашего наблюдения или исследования. Системой может быть, например, колба с реакционной смесью, человек, теплообменник на предприятии.
Остальная часть материального мира, т.е. за пределами условно выделенной из него системы, – окружающая среда.
Термодинамическая система обязательно должна содержать большое число частиц (молекул, атомов). Системы с малым числом частиц термодинамика не рассматривает.
Взаимодействие системы с окружающей средой состоит из обмена энергией и веществом. Различают открытые, закрытые и изолированные системы.
| Термодинамические системы |
| открытые – обмениваются с окружающей средой и веществом и энергией, например, все открытые реакторы, человек. |
| закрытые – обмениваются с окружающей средой только энергией, например, закрытые реакторы. |
| изолированные – не обмениваются с окружающей средой ни веществом, ни энергией, например, адиабатические реакторы. |
Состояние любой термодинамической системы может быть охарактеризовано количественно с помощью термодинамических параметров состояния. Различают два типа параметров состояния.
Экстенсивные параметры пропорциональны количеству вещества системы. Например, объем, масса, площадь поверхности, заряд.
Интенсивные параметры не зависят от количества вещества (температура, давление, поверхностное натяжение). Интенсивными параметрами являются также удельные (т.е. отнесенные к чему-либо) значения экстенсивных параметров, например, концентрации веществ, мольные объемы.
Уравнения, связывающие параметры состояния термодинамической системы, – уравнения состояния данной системы.
Например, уравнением состояния идеального газа является уравнение Менделеева-Клапейрона
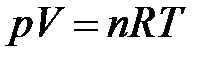 . (1.1)
. (1.1)
В качестве параметров состояния идеального газа могут быть выбраны любые два параметра из трех – p, V, T. Этого достаточно, поскольку третий параметр может быть рассчитан по уравнению (1.1).
Процесс – это любое изменение в системе, приводящее к изменению, по крайней, хотя бы одного параметра состояния.
Отметим некоторые частные виды процессов:
1) изотермический (T = const);
2) изобарный (р = const);
3) изохорный (V = const);
4) адиабатический (нет теплообмена с окружающей средой);
5) изобарно-изотермический (р, T = const);
6) изохорно-изотермический (V, T = const).
Если в результате процесса система возвращается в исходное состояние, такой процесс называется круговым (или циклом). Циклические процессы часто совершаются в природе и технике, например, при работе двигателя внутреннего сгорания.
Материя не может существовать без движения, а мерой движения является энергия.
Энергия (философская категория) – это мера способности системы совершать работу. Энергия может существовать в разнообразных формах, например, химическая, электрическая, механическая, ядерная, солнечная энергия.
Механическая энергия, в свою очередь, подразделяется на кинетическую энергию и потенциальную энергию.
Кинетическая энергия – это энергия, связанная с движением тела.
Потенциальная энергия – это энергия, запасенная телом.
Химическая система может состоять из атомов, молекул и ионов либо из любой их комбинации. Все эти частицы обладают кинетической и потенциальной энергией. Сумма кинетической и потенциальной энергий всех частиц в системе называется внутренней энергией системы. Внутренняя энергия обозначается буквой U.
Кинетическая энергия движения самой системы и потенциальная энергия положения ее в пространстве во внутреннюю энергию не входят.
Абсолютное значение внутренней энергии определить невозможно, но легко найти изменение ее ΔU при переходе системы из исходного состояния 1 в конечное 2:
| DU |
| 1 (U1) |
| 2 (U2) |
Величина ΔU считается положительной, если в рассматриваемом процессе внутренняя энергия системы возрастает.
Работа А и теплота Q – две возможные формы передачи энергии от одной системы к другой. При этом теплота связана с беспорядочным (хаотическим) перемещением микрочастиц: энергия передается путем хаотических столкновений молекул соприкасающихся тел, т.е. путем теплопроводности. Работа – форма передачи энергии путем упорядоченного движения частиц. Например, расширение газа, находящегося под давлением.
Теплота и работа, в отличие от внутренней энергии, не являются свойствами системы: они возникают только тогда, когда возникает процесс, и характеризуют только процесс. Теплота и работа в общем случае являются функцией процесса.
Внутренняя энергия – функция состояния. Термодинамические функции состояния – это величины, которые зависят от параметров состояния.
Термодинамические функции состояния имеют ряд важных свойств.
1) Изменение функции состояния определяется только исходным и конечным состоянием системы и не зависит от пути перехода этой системы из исходного в конечное состояние. С математической точки зрения это означает, что любое бесконечно малое изменение функции состояния системы является полным дифференциалом:
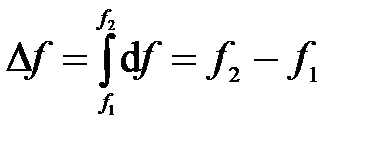 .
.
В круговом процессе конечное состояние совпадает с начальным, поэтому любая функция состояния принимает первоначальное значение, а ее изменение равно нулю:
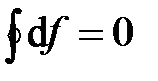 .
.
2) Свойство аддитивности: величина термодинамической функции для всей системы складывается из величин этой функции для определенных частей системы.
Единица измерения Q, U, A в системе СИ – Дж (Н×м).
Первый закон термодинамики
Дата добавления: 2016-06-22; просмотров: 1776;











