Обратимые и необратимые
Все процессы, протекающие в природе, могут быть разделены на самопроизвольные и несамопроизвольные.
Самопроизвольным, или положительным, называется процесс, который совершается в системе без вмешательства со стороны окружающей среды. Например, переход теплоты от горячего тела к холодному, плавление льда при t > 0 °С.
| Т1 Т2 |
| Q |
Свойства самопроизвольных процессов.
1) Скорость самопроизвольных процессов измерима (достаточно велика).
2) Достаточно велика и их движущая сила.
3) Самопроизвольные процессы приближают систему к состоянию равновесия, из которого она самопроизвольно выйти не может.
4) Самопроизвольные процессы термодинамически необратимы, т.е. после их протекания систему и окружающую среду одновременно нельзя вернуть в первоначальное состояние: систему можно вернуть в прежнее состояние, затратив работу, но при этом произойдут изменения в окружающей среде (например, изменится энергия окружающих тел).
5) При протекании самопроизвольного процесса совершается работа Ан/о (работа необратимого процесса).
Если при осуществлении процесса система может вернуться в исходное состояние, не оставляя видимых изменений в окружающей среде, такой процесс является термодинамически обратимым. При этом в обратном направлении система проходит через те же промежуточные состояния, что и в прямом. Это значит, что в ходе прямого процесса должна производиться работа Аобр., достаточная для того, чтобы вернуть систему в исходное состояние без помощи внешней среды.
Термодинамическое понятие обратимости не совпадает со значением этого термина в химической кинетике. Обратимой в кинетике считают реакцию, результирующая скорость которой определяется разностью скоростей протекания ее в прямом и обратном направлениях, причем на величину этой разности не накладывается каких-либо ограничений.
Для термодинамической обратимости требуется, чтобы реакция проходила в условиях, бесконечно близких к равновесию, когда скорости прямого и обратного процессов различаются на бесконечно малую величину.
Основные свойства обратимых процессов.
1) Обратимые процессы идут с бесконечно малой скоростью.
2) Движущая сила обратимых процессов бесконечно мала.
3) Для реализации обратимого процесса система должная пройти через бесконечно большое число стадий.
4) Работа, производимая системой в ходе обратимого процесса, максимальна: Аобр. = Аmax
В природе и технике протекают только необратимые процессы. Но любой реальный процесс можно представить протекающим в условиях, сколь угодно близких к условиям обратимого процесса. Сравнивая реальный процесс с обратимым, можно в каждом конкретном случае указать пути повышения эффективности процесса.
Наилучшей моделью обратимого процесса может служить бесконечно медленно протекающий процесс.
| газ 1 моль |
| Рис. 1.3 |
(Т = const) расширения 1 моль идеального газа в цилиндре с поршнем (рис. 1.3). Поршень движется без трения. На поршень помещен груз в виде горки песка, поддерживающий заданное давление газа р1. Состояние системы описывается двумя параметрами – p и V (рис. 1.4). Кривая AEKB – изотерма равновесия газа. При снятии груза поршень поднимается, объем газа увеличивается, совершается работа расширения.
| С |
| L |
| F |
| D |
| K |
| E |
| B |
| A |
| V1 V2 V |
| р р1 р2 |
| Рис. 1.4 |
1. Сразу снизить нагрузку на поршень до давления р2, объем газа резко возрастет и станет равным V2. При этом совершится работа расширения
A = p2(V2 – V1),
которая равна площади под ломаной кривой АСВ.
2. Процесс можно провести через ряд последовательных стадий, например, снимать с поршня определенные (конечные) порции песка. Как только объем газа достигнет значения, отвечающего новому давлению на поршень, в системе установится равновесие.
Работа возрастет на величину площади фигуры DEFKLC и станет равной
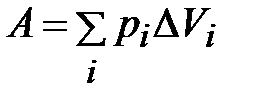 ,
,
где рi – внешнее давление; DVi – изменение объема, отвечающее данному давлению (при снятии соответствующего груза).
При увеличении числа стадий, т.е. при уменьшении снимаемой нагрузки, работа еще более возрастает.
В пределе, когда снимаемый груз бесконечно мал (снимаем по одной песчинке), а число стадий бесконечно велико, система все время будет приближена к состоянию равновесия. Такой процесс будет обратимым, работа его максимальна:
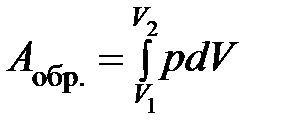 (1.17)
(1.17)
Под интегралом находятся две зависимые переменные – р и V. Произведем замену, используя уравнение состояния идеального газа (1.1):

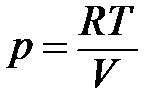 .
.
После подстановки в (1.17)
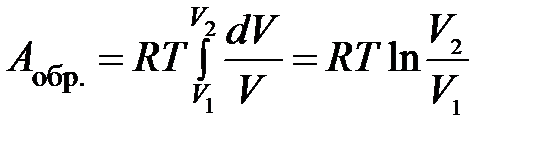 ,
,
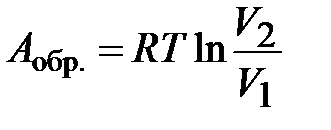 . (1.18)
. (1.18)
Уравнение (1.18) применяется для расчета работы обратимого расширения 1 моль идеального газа.
Выводы:
1) работа обратимо протекающих процессов максимальна, работа реальных процессов всегда меньше;
2) чем выше степень необратимости процесса, тем меньше работа, производимая системой.
Если I закон термодинамики применим к любым термодинамическим процессам в равной мере, то II закон имеет различное выражение при применении его к обратимым и необратимым процессам.
Дата добавления: 2016-06-22; просмотров: 2850;











