СВЯЗЬ СТАНДАРТНОГО ИЗМЕНЕНИЯ ЭНЕРГИИ ГИББСА РЕАКЦИИ С КОНСТАНТОЙ РАВНОВЕСИЯ.
Если в момент смешения газов, вступающих в реакцию
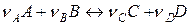 ,
,
парциальные давления (концентрации) каждого участника равны единице (все вещества вступают в реакцию в своих стандартных состояниях), то уравнение изотермы Вант–Гоффа (ур-е 4.15) превращается в уравнение для расчёта энергии Гиббса в стандартных условиях (ур-е 4.13):
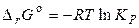 .
.
Оно характеризует способность различных веществ вступать в химическое взаимодействие и не зависит от пути процесса, а определяется только природой веществ. Знак DrG o указывает на направление самопроизвольного процесса, протекающего в стандартных условиях. Чем меньше эта величина, тем больше Кр, тем глубже идет процесс. При равновесии величина DrG равна нулю, т.е. дальнейшее самопроизвольное изменение в системе исключено.
Стандартный изобарный потенциал химической реакции (или химическое сродство веществ) равен изобарному потенциалу химической реакции
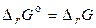 (4.20)
(4.20)
при условии, что парциальные давления всех веществ, участвующих в реакции, равны рo = 1 атм = 101325 Па.
В общем случае (для реальных и идеальных систем) справедливо:
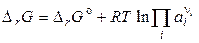 ,
,
где ai – активность компонента или отношение парциального давления газа к стандартному давлению (ai – безразмерная величина) т. е.
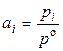 . (4.21)
. (4.21)
Величину 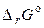 при Т = 298.15 К находят на основании справочных данных:
при Т = 298.15 К находят на основании справочных данных:
1). 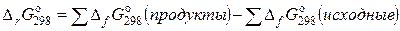 , где
, где 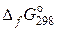 – стандартная свободная энергия Гиббса образования вещества.
– стандартная свободная энергия Гиббса образования вещества.
2). 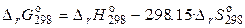 .
.
Аналогично проводят расчёт 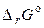 при других температурах с учётом температурной зависимости энтальпии и энтропии реакции:
при других температурах с учётом температурной зависимости энтальпии и энтропии реакции:
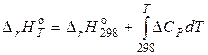 , (4.22)
, (4.22)
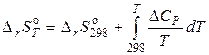 . (4.23)
. (4.23)
При известных значениях 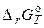 и начальных парциальных давлениях или активностях участвующих в реакции веществ расчёт
и начальных парциальных давлениях или активностях участвующих в реакции веществ расчёт 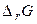 проводят по формулам:
проводят по формулам:
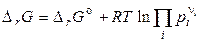 , (4.24)
, (4.24)
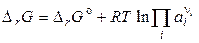 . (4.25)
. (4.25)
Дата добавления: 2016-06-18; просмотров: 2044;











