РАСЧЕТ ХИМИЧЕСКОГО ПОТЕНЦИАЛА.
Для системы, состоящей из одного вещества, справедливо:
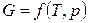 ,
, 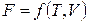 .
.
Если система состоит из нескольких компонентов, то
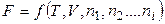 , (2.46)
, (2.46)
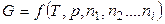 , (2.47)
, (2.47)
где ni – число молей i-го компонента. Любая экстенсивная функция состояния является функцией количества вещества в системе.
Продифференцируем (2.46) и (2.47) по ni:
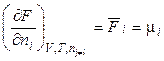 , (2.48)
, (2.48)
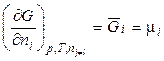 , (2.49)
, (2.49)
где μi – химический потенциал i-го компонента в системе. Его ещё называют парциальной мольной энергией Гиббса (парциальная термодинамическая функция Гиббса) или парциальной мольной энергией Гельмгольца (парциальная термодинамическая функция Гельмгольца), т.к. 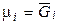 и
и 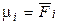 .
.
Можно дать следующее определение химического потенциала:
химический потенциал равен приращению энергии Гиббса (или любой другой характеристической функции) при увеличении массы данного вещества на 1 моль, если массы всех остальных веществ, температура или давление (или другие естественные переменные для других функций) остаются постоянными.
Любая энергетическая характеристика есть произведение интенсивного фактора на экстенсивный. В нашем случае μi – интенсивный параметр, а ni – экстенсивный.
Тогда
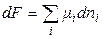 при V, T = const,(2.50)
при V, T = const,(2.50)
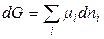 при T, p = const. (2.51)
при T, p = const. (2.51)
Введение некоторого количества dni молей i–го компонента при постоянном количестве других компонентов и постоянных Т и р будет увеличивать значение энергии Гиббса на величину 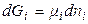 . Аналогичные изменения будут вызваны прибавлением других компонентов. Общее изменение энергии Гиббса системы равно:
. Аналогичные изменения будут вызваны прибавлением других компонентов. Общее изменение энергии Гиббса системы равно:
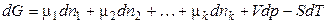 , (2.52)
, (2.52)
или, в общем случае,
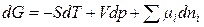 , (2.53)
, (2.53)
которое получило название фундаментального уравнения Гиббса.
Для любой химической реакции:
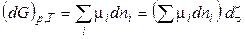 , (2.54)
, (2.54)
где 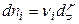 (
( 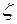 – химическая переменная или степень протекания реакции).
– химическая переменная или степень протекания реакции).
При р, Т = const для химической реакции верно:
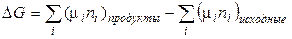 . (2.55)
. (2.55)
Расчёт химического потенциала:
1. Для 1 моля идеального газа.Для индивидуального вещества 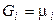 и
и 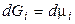 , тогда при Т = const
, тогда при Т = const
dG = Vdp-SdT = Vdp, (2.56)
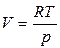 и
и 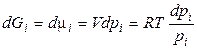 , (2.57)
, (2.57)
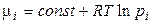 , (2.58)
, (2.58)
где рi – давление индивидуального газа. Обычно const рассчитывают при Т = 298 К и рo = 1,013·105 Па, тогда
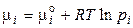 . (2.59)
. (2.59)
2. Для смеси идеальных газов:
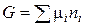
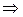
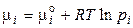 , (2.60)
, (2.60)
где рi – парциальное давление i–го газа, и 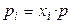 , где
, где 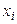 – мольная доля i–го газа в смеси, p – общее давление в системе. Отсюда
– мольная доля i–го газа в смеси, p – общее давление в системе. Отсюда
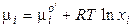 . (2.61)
. (2.61)
3. Для смеси реальных газов. С увеличением давления и понижением температуры газы всё больше становятся неидеальными, т. е. перестают подчиняться уравнению состояния идеального газа. Поэтому для реального газа в выражения химической термодинамики вместо парциального давления (рi) подставляют летучесть (фугитивность fi ). Численно летучесть выражается как 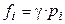 , где γ – коэффициент летучести, характеризующий степень отклонения газа от идеальности. Тогда
, где γ – коэффициент летучести, характеризующий степень отклонения газа от идеальности. Тогда
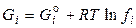 , (2.62)
, (2.62)
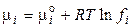 . (2.63)
. (2.63)
4. Для идеальных и реальных растворов. В неидеальных растворах концентрация перестаёт быть величиной, однозначно определяющей свойства раствора, поэтому концентрацию заменяют активностью. Введением активности формально учитывается взаимодействие между молекулами растворителя, эффект сольватации и т.п. Активность можно назвать эффективной концентрацией, при которой идеальный раствор приобретает термодинамические свойства данного реального раствора. Тогда: для идеальных растворов
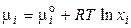 ; (2.64)
; (2.64)
для реальных растворов
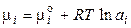 , (2.65)
, (2.65)
где 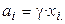 и
и 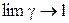 при
при 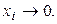
ЛЕКЦИЯ 3
Термодинамика химического равновесия. Константа химического равновесия. Закон действующих масс. Принцип Ле-Шателье. Изотерма химической реакции. Связь стандартного изменения энергии Гиббса реакции с константой равновесия. Равновесие в гетерогенных реакциях. Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции.
Дата добавления: 2016-06-18; просмотров: 4467;











